
【题目】新一代锂电池的反应为:FePO4+Li ![]() LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
A.放电时电池正极反应为:FePO4+Li++e﹣═LiFePO4
B.充电时LiFePO4只发生氧化反应不发生还原反应
C.充电过程中,电池正极材料的质量增加
D.加入硫酸可以提高电解质的导电性
科目:高中化学 来源: 题型:
【题目】某有机物含C,H,O,N四种元素,质量分数分别为32%、6.66%、42.67%、67%.该有机物的蒸汽对氢气的相对密度为37.5.通过计算确定:
(1)有机物的分子式;
(2)有机物可能的结构简式. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2 , 分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度
B.在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05molL﹣1下降到0.03 molL﹣1 , 该双氧水在这2h中分解的平均反应速率约为0.015 molL﹣1h﹣1
C.其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D.一定条件下,固定体积的容器中发生反应A(g)+B(g)2C(g),当容器内A,B,C的浓度之比为1:1:2时,该反应一定处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )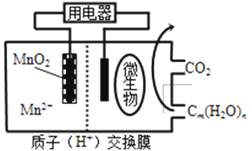
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H++2e﹣═Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境、缓解能源危机.有些城市开始尝试用乙醇(C2H5OH)代替汽油作汽车燃料。乙醇的官能团是( )
A. —CH3 B. —COOH C. —OH D. H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)+B(g)2C(g)+2D(g) 在不同条件下的反应速率分别为:(1)v(A)=0.6molL﹣1min﹣1 ;(2)v(B)=0.007molL﹣1S﹣1;(3)v(C)=0.4molL﹣1min﹣1 ;(4)v(D)=0.80molL﹣1min﹣1 , 此反应在不同条件下进行最快的是( )
A.(1)
B.(2)
C.(3)
D.(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近几年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如1图所示.据此判断:
2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如1图所示.据此判断: 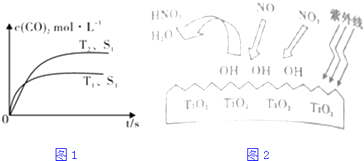
①该反应的△H0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线 .
③研究表明在紫外线照射下,由于TiO2的催化作用,空气中的某些物质会产生OH自由基,如图2所示,OH与NO2反应为NO2+OH=HNO3 , 写出NO与OH反应的化学方程式
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.NH3与CO2在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)(NH2)2CO(s)+H2O(g).现将物质的量为1:1的NH3与CO2混合在密闭固体容器中反应,平衡后,NH3的体积分数为20%,则NH3的平衡转化率为 .
③25℃时,将amolL﹣1的氨水与b molL﹣1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3H2O的电离平衡常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如表所示。正确的是 ( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>乙D. 最外层电子数:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com