

| A、△H>0,m+n>x |
| B、△H<0,m+n>x |
| C、△H>0,m+n<x |
| D、△H<0,m+n<x |


科目:高中化学 来源: 题型:
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、葡萄糖能发生氧化反应和水解反应 |
| D、蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2+H2SO4═BaSO4+2 H2O |
| B、2NaOH+CO2═Na2CO3+H2O |
| C、HCl+NaOH═NaCl+H2O |
| D、2HCl+Na2CO3═2NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①④⑥⑧ | B、①③⑥⑦ |
| C、②③⑤⑧ | D、②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A、容器①、②中反应达平衡时,状态完全相同 |
| B、①平衡时,N2的转化率为25% |
| C、容器②中达平衡时放出的热量Q<23.15 kJ |
| D、若向容器①加入2molN2、6molH2,则平衡时放出的热量23.15kJ<Q1<46.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
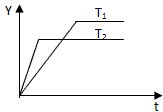 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )| A、N2的转化率 |
| B、混合气体的平均摩尔质量 |
| C、容器的体积 |
| D、混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
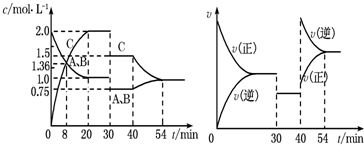
| A、30 min~40 min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30 min时降低温度,40 min时升高温度 |
| D、8 min前A的平均反应速率为0.08 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电能力一定强于弱电解质溶液 |
| B、乙酸溶液中存在的微粒有CH3COOH、CH3COO-、H+、OH-、H2O |
| C、0.05mol的NaOH固体分别加入到体积都是100ml的自来水、0.5mol/L的乙酸、0.5mol/L的盐酸和0.5mol/L的NaCl溶液中,溶液导电能力变化最小的是自来水 |
| D、在相同温度下,a强电解质,b弱电解质,c金属Al的导电能力相同,升高温度后它们的导电能力都增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com