
完成下列小题。
(1)[2013·江苏,20(1)]白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)[2013·四川理综,11(5)节选]焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)
ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是________。
(3)[2013·浙江理综,27(1)]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)ΔH3
ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(4)[2013·天津理综,10(2)①]为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+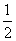 O2(g)===H2O(g)
O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
C(s)+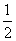 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:______________________________________。
(5)[2013·北京理综,26(2)①]汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
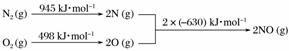
写出该反应的热化学方程式:____________________________________。
答案 (1)+2 821.6
(2)SO3(g)+H2O(l)===H2SO4(l)
ΔH=-130 kJ·mol-1
(3)2ΔH2-ΔH1
(4)C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131.3 kJ·mol-1
(5)N2(g)+O2(g)===2NO(g) ΔH=+183 kJ·mol-1
解析 (1)2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1①
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1②
由盖斯定律,目标反应可由反应①+反应②×6,则ΔH3=ΔH1+ΔH2×6=+2 821.6 kJ·mol-1。
(2)根据盖斯定律,得出SO3(g)+H2O(l)===H2SO4(l) ΔH4只须按下式进行即可:
ΔH=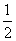 (ΔH3-ΔH1-2ΔH2)=-130 kJ·mol-1,
(ΔH3-ΔH1-2ΔH2)=-130 kJ·mol-1,
热化学方程式应为
SO3(g)+H2O(l)===H2SO4(l) ΔH=-130 kJ·mol-1。
(3)Ⅱ式×2-Ⅰ式,即可得反应Ⅲ。
(4)下式减上式即可求得热化学方程式。
(5)拆开化学键吸收能量,形成化学键释放能量
N2(g)+O2(g)===2NO(g)其ΔH计算方法如下:
ΔH=945 kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol-1=+183 kJ·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
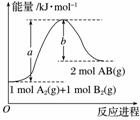
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源分类相关图如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
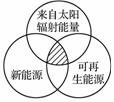
A.煤炭、石油、沼气
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、核能
查看答案和解析>>
科目:高中化学 来源: 题型:
)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、O===O和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )
A.-332 B.-118
C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: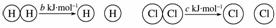
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为(a+b+c)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:

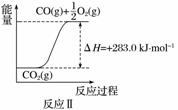
①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。

查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)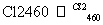 SiCl4
SiCl4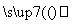 SiCl4(纯)
SiCl4(纯)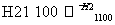 Si(纯)
Si(纯)
写出SiCl4的电子式:______________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气, 减小
减小
B.通入少量SO2,溶液漂白性增强
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强
D.光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com