
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
分析 分子式为C8H11N的有机物,分子内含有苯环和氨基,可看作氨基取代乙苯(二甲苯)的H,依据乙苯(二甲苯)中的等效H确定取代位置,即可确定同分异构体个数.
解答 解:乙苯苯环上1个乙基,二甲苯苯环上连有2个甲基,分别又处于邻间对的位置,故烃基结构总共有4种;
乙苯分子中含有5种等效H,故氨基的取代方式有5种;
邻二甲苯中有3种等效H,故氨基的取代方式有3种;
间二甲苯中有4种等效H,故氨基的取代方式有4种;
对二甲苯中有2种等效H,故氨基的取代方式有2种,故总共有:5+3+4+2=14种,
故选C.
点评 本题主要考查的是同分异构体数目的判断,为高频考点,侧重考查学生的分析能力,利用等效H法是解决此类题目的常用方法,难度不大.


科目:高中化学 来源: 题型:解答题
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 .
. .
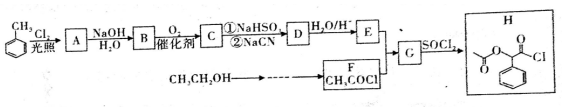
. ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应. (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
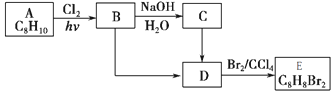
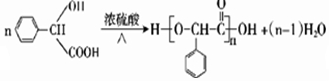
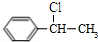 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$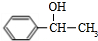 +NaCl
+NaCl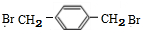 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度:a>b,且a点所示溶液中由水电离出的c(OH-)=10-8.7mol/L | |
| C. | pH=7时溶液中c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| D. | b点所示溶液中c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.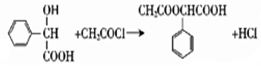 .
.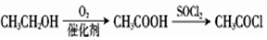 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com