
【题目】A、B、C、X为中学化学常见物质,且A、B、C含有相同元素甲,可以发生如下转化关系(水参与的反应,水未标出)。
![]()
(1)若A、B、C的焰色反应呈黄色,C为淡黄色固体,则X是__________。
(2)若A、B、C的焰色反应呈黄色,X是CO2,写出B→C反应的方程式_________。
(3)若B是FeCl3,则X一定是_________,写出B→C反应的离子方程式_________。
【答案】O2 (氧气) CO2 +Na2CO3+ H2O=2NaHCO3 Fe 2Fe3+ +Fe=3Fe2+
【解析】
(1)若A、B、C的焰色反应呈黄色,说明含有钠元素,C为淡黄色固体,说明C为过氧化钠,则A为Na、B为Na2O、则X是氧气;故答案为:O2 (氧气)。
(2)若A、B、C的焰色反应呈黄色,说明含有钠元素,X是CO2,说明A为NaOH、B为Na2CO3、C为NaHCO3,B→C反应是碳酸钠与二氧化碳和水反应生成碳酸氢钠,其方程式Na2CO3 + CO2 + H2O=2NaHCO3;故答案为:Na2CO3 + CO2 + H2O=2NaHCO3。
(3)若B是FeCl3,则说明A为Cl2、C为FeCl2,则X一定是Fe,B→C是氯化铁和铁反应生成氯化亚铁,其反应的离子方程式2Fe3+ +Fe=3Fe2+。


科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
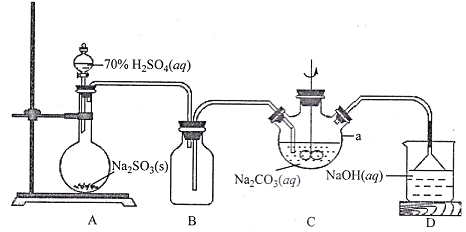
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
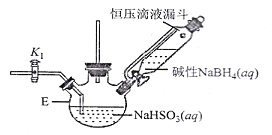
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.1L0.2mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.2NA
B.H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移2NA个电子
C.3.6gCO和N2的混合气体含质子数为1.8NA
D.常温常压下,30g乙烷气体中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g) + H2O (g)![]() CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A.x = y = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)=0.004"mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入1mol的![]() 和
和![]() 发生反应:
发生反应:![]() ;
;![]() ,
,![]() 的物质的量与时间的关系如表所示,下列说法错误的是( )
的物质的量与时间的关系如表所示,下列说法错误的是( )
时间 | 0 |
|
|
|
| 0 |
|
|
|
A.![]() 内,
内,![]()
B.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C.![]() 的活化能小于
的活化能小于![]() 的活化能
的活化能
D.![]() 时再加入1mol的
时再加入1mol的![]() 和
和![]() ,反应达新平衡时,
,反应达新平衡时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数小于0.1NA
B.22.4L(标准状况)氩气含有的分子数为0.5NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是

A.恒温恒容下,再向B点体系充入N2O4,NO2的体积分数增大
B.图中A、C两点气体的颜色:A浅,C深
C.图中A、C两点气体的平均相对分子质量:A>C
D.温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3-
B. Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑
C. 电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com