
| A. | 3Cl2+6KOH═5KCl+KClO3+3H2O | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2AgNO3+BaCl2═2AgCl↓+Ba(NO3)2 |
分析 发生的反应中,存在元素的化合价变化,则为氧化还原反应;反之,不存在元素的化合价变化,则不是氧化还原反应,以此来解答.
解答 解:A.在3Cl2+6KOH═5KCl+KClO3+3H2O反应中氯元素的化合价变化,为氧化还原反应,故A不选;
B.在CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O反应中,Cu、H元素的化合价变化,为氧化还原反应,故B不选;
C.在2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑反应中,Mn、O元素的化合价变化,为氧化还原反应,故C不选;
D.在2AgNO3+BaCl2═2AgCl↓+Ba(NO3)2反应中,没有元素的化合价变化,不是氧化还原反应,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,题目难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
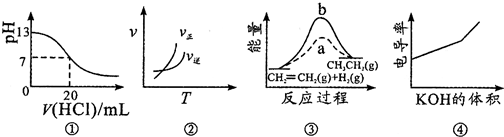
| A. | 图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应A2(g)+3B2(g)?2AB3(g)△H<0 | |
| C. | 图③中a、b曲线分别表示反应CH2═CH2(g)+H2(g)═CH3CH3(g)△H<0,使用和未使用催化剂时反应过程中的能量变化 | |
| D. | 电导率是衡量电解质溶液导电能力大小的物理量,图④表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
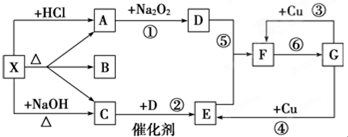
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
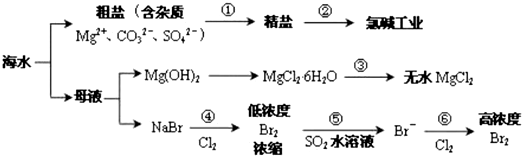
| A. | 过程①除杂的顺序:NaOH 溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O 灼烧即可制得无水 MgCl2 | |
| C. | 在过程④、⑥反应中每氧化 0.2 mol Br- 需消耗2.24 LCl2 | |
| D. | 从第④步到第⑥步的目的是为了富集溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com