
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)反应①达平衡后采取下列措施,能提高CH3OH产率的有__________。
A.加入H2 B.升高温度 C.增大压强 D.使用催化剂
(3)在一定温度下,将4mol CO和4mol H2混合置于2L的密闭容器中发生反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
(4)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
A. 氢气和二氧化碳的浓度之比为3∶1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(5)二甲醚燃料电池的工作原理如图所示:

该电池负极的电极反应式为__________。
【答案】-246.1 AC75%1.5mol/(Lmin)或0.025mol/(LS) 16DE3H2O+CH3OCH3-12e-=2CO2+12H+
【解析】
(1)根据盖斯定律,通过①×2+②+③可得反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g), △H=-246.1 kJ·mol-1;综上所述,本题答案是:-246.1。
CH3OCH3(g)+CO2(g), △H=-246.1 kJ·mol-1;综上所述,本题答案是:-246.1。
(2)A.增加H2的浓度,平衡右移, CH3OH产率提高,正确;
B.反应放热,升高温度, 平衡左移,CH3OH产率降低,错误;
C.增大压强,平衡右移, CH3OH产率提高,正确;
D.使用催化剂,可以加快反应速率,平衡不移动,转化率不变,CH3OH产率不变,错误;
综上所述,本题答案是:AC。
(3)将4mol CO和4mol H2混合置于2L的密闭容器中发生反应, 设生成CO2的量为x,则:
3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),
CH3OCH3(g)+CO2(g),
起始量 4 4 0 0
变化量 3x 3x x x
平衡量 4-3x 4-3x x x
60s时达到平衡状态时,测得气体的总物质的量为4mol,4=4-3x+4-3x+x+x,x=1mol;达平衡时,氢气的转化率为(3×1)/4×100%=75% ;CO变化的浓度为3×1/2=1.5mol/L, CO的反应速率为1.5/60=0.025mol/(LS) (或1.5mol/(Lmin);反应达平衡时各物质浓度分别为:c(H2)=(4-3)/2=0.5mol/L, c(CO)=(4-3)/2=0.5mol/L, c(CH3OCH3)=1/2=0.5 mol/L,c(CO2)= 1/2=0.5 mol/L, 该反应的平衡常数=c(CO2)c(CH3OCH3)/c3(H2)c3(CO)= 0.52/0.56=16;综上所述,本题答案是:75%,0.025mol/(LS) (或1.5mol/(Lmin)),16。
(4)A.不清楚开始时通入量是多少,因此两者浓度比为3:1,无法判断是否达到平衡,故A错误;
B.断裂3个H-H键,消耗3个H2,断裂1个C=O 键,消耗0.5个CO2,两者比值不等于化学计量数之比,因此不能说明反应达到平衡,故B错误;
C.组分都是气体,因此气体质量不变,又是恒容状态,体积不变,根据密度的定义,密度始终不变,因此密度不变,不能说明反应达到平衡,故C错误;
D.组分都是气体,气体质量不变,但反应前后气体系数之和不等,根据摩尔质量的定义,摩尔质量发生变化,因此当平均摩尔质量不变,说明反应达到平衡,故D正确;
E.是绝热容器,温度发生变化,当温度不再改变,说明反应达到平衡,故E正确;
综上所述,本题选DE。
(5)该电池为原电池,二甲醚在负极发生氧化反应,生成二氧化碳,电解质为酸性溶液,所以负极的电极反应式为3H2O+CH3OCH3-12e-=2CO2+12H+;综上所述,本题答案是:3H2O+CH3OCH3-12e-=2CO2+12H+。


科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律
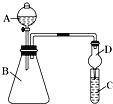
(1)仪器B的名称为__________,干燥管D的作用为__________;
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,C溶液中的离子方程式为_____________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________________溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加________(写化学式)溶液,若观察到C中出现白色沉淀,即可证明,但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有__________溶液的___________(填装置名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨肥样品可能含有NH4HCO3、NH4Cl、.NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液,将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL0.2 mol·L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol·L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mlL0.15 mol·L-1的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO30.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4Cl
C. 原样品的含氨量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国合成的材料中,主要成分由同周期两种元素组成的是
A.可实现高温超导的钙钛矿(CaTiO3)薄膜
B.制造大口径高精度非球面反射镜的碳化硅材料
C.大面积单品六方氮化硼半导体材料
D.可淡化海水的石墨烯纳米网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 锌锰干电池中,锌电极是负极
C. 氢氧燃料电池可把化学能转化为电能
D. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 大理石与醋酸反应:CO32-+2CH3COOH![]() 2CH3COOˉ+H2O+CO2↑
2CH3COOˉ+H2O+CO2↑
B. 高锰酸钾与浓盐酸制氯气的反应:MnO4-+4Clˉ+8H+![]() Mn2++2Cl2↑+4H2O
Mn2++2Cl2↑+4H2O
C. 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClOˉ![]() SO42-+Clˉ+2H+
SO42-+Clˉ+2H+
D. 氢氧化钠溶液与过量的碳酸氢钙溶液反应:OHˉ+Ca2++HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com