
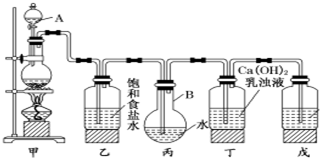
分析 (1)熟悉仪器的形状说出其名称;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯化氢、氯气在饱和食盐水中溶解度性质选择除杂剂;
(4)氯气有毒,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收.
解答 解:(1)图中仪器A为分液漏斗,B为圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$ MnCl2+Cl2↑+2H2O;
氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,化学方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$ MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用盛有饱和氯化钠溶液的乙除去氯化氢气体,
故答案为:除去HCl气体;
(4)氯气有毒,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收,化学式为NaOH,故答案为:NaOH.
点评 本题考查了氯气的实验室制备方法,明确氯气的制备原理和氯气的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH值 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| A. | CO2+H2O+NaClO═NaHCO3+HClO | B. | CO2+H2O+2NaClO═Na2CO3+2HClO | ||
| C. | CH3COOH+NaCN═CH3COONa+HCN | D. | CH3COOH+NaClO═CH3COONa+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、纯碱、石英均为电解质 | D. | 氯水、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量 | |
| B. | X和Y的总能量一定高于M和N的总能量 | |
| C. | Y的能量一定高于N | |
| D. | 因为该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水显碱性:NH3•H2O═NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸可以干燥SO2、H2等气体 | |
| B. | 常温下浓硫酸可以使Al、Fe发生钝化 | |
| C. | 浓硫酸可以使蔗糖发生炭化 | |
| D. | 用浓硫酸和NaCl固体加热制备HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com