
【题目】25℃时,下列有关电解质溶液说法正确的是 ( )
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向 NaF 溶液中滴加硫酸至中性时,2c(![]() )=c(HF)
)=c(HF)
C.向氨水中加入 NH4Cl 固体,溶液中![]() 增大
增大
D.pH=a 的氨水,稀释至原体积的 10 倍后,其 pH=b,则 b<a-1
【答案】B
【解析】
A. 稀醋酸中加入冰醋酸,醋酸电离平衡右移,但电离度减小,故A错误;
B. 向NaF溶液中滴加硫酸至中性时,溶液中物料守恒为:c(Na+)=c(HF)+c(F-),电荷守恒为c(Na+)+c(H+)=c(OH-)+c(F-)+2c(SO42-),消去钠离子的浓度可得:c(HF)+c(H+)=c(OH-)+2c(SO42-),溶液显中性,则c(H+)=c(OH-),所以c(HF)=2c(SO42-),故B正确;
C. 铵根离子的水解常数Kh=![]() ,溶液的温度不变,水解常数不变,故C错误;
,溶液的温度不变,水解常数不变,故C错误;
D. 加水稀释促进一水合氨电离,稀释10倍后导致溶液中氢氧根离子浓度大于原来的![]() ,pH变化小于1,所以稀释后的pH=b>a-1,故D错误;
,pH变化小于1,所以稀释后的pH=b>a-1,故D错误;
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________。
(2)广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是 ___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______。
A.HCN B.HClO C.CH3COOH D.H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH1;
4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
c. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
①主反应的ΔH1=____________。
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是______(填序号)。

a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_______________。
(2)已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。
7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。

(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。(用分数表示)
=___________。(用分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:__________________________,证明______________________。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下。

(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测量碳铁合金的含碳量,提出了如下三种实验方案。
方案Ⅰ:含碳铁合金粉末与浓硫酸在一定条件下反应,用下列装置![]() 加持装置省略
加持装置省略![]() 既可检验产物中除
既可检验产物中除![]() 外混合气体的成分,又可通过测量
外混合气体的成分,又可通过测量![]() 的质量来计算合金的含碳量。
的质量来计算合金的含碳量。

(1)合金与浓硫酸在一定条件下生成![]() 的反应中,做还原剂的物质时____(填化学式)。
的反应中,做还原剂的物质时____(填化学式)。
(2)为实现实验目的,上述仪器正确的连接顺序![]() 按气流方向
按气流方向![]() 为:混合气体→____→____→______→(a)(b)→_____→_______→(k)(l)。
为:混合气体→____→____→______→(a)(b)→_____→_______→(k)(l)。
(3)装置E中所装药品为 ______ ![]() 填字母序号
填字母序号![]() ;在本实验中的作用是 ______ 。
;在本实验中的作用是 ______ 。
A 碱石灰 B 无水氯化钙 C 浓硫酸
(4)若能观察到 ______ 的现象,则证明原混合气体中一定含有![]() 。
。
(5)实验后最终测量的含碳量偏低,某同学猜测混合气体中有可能含有CO,在G后增加一个装置即可验证他的猜测,请简要说明验证这个猜测所需装置及药品和具体实验现象 ______ 。
方案Ⅱ:称取粉末状样品![]() ,加入某浓度的稀硫酸100mL,充分反应后,收集到标准状况下气体
,加入某浓度的稀硫酸100mL,充分反应后,收集到标准状况下气体![]() ,然后继续往样品中加入同浓度的稀硫酸100mL,充分反应后又收集到标准状况下气体1.12L。则合金中碳的质量分数为 ______(保留三位有效数字)。
,然后继续往样品中加入同浓度的稀硫酸100mL,充分反应后又收集到标准状况下气体1.12L。则合金中碳的质量分数为 ______(保留三位有效数字)。
方案Ⅲ:利用灼烧法使合金中的碳转化为二氧化碳,合金质量会减轻从而计算含碳量,但是他们将一定量的样品灼烧后,发现质量反而增加了,其原因是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g)△H<O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
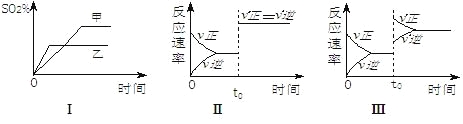
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻通入氦气对反应速率的影响
C.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
D.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
a.98%的浓硫酸 b.1%的品红溶液 c.1.0 mol·L-1的KI-淀粉溶液
d.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为_______mol·L-1(用含a、b、v1、v2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A. 与W相邻的同主族元素可制成重要的半导体材料
B. X单质不可能置换出W单质
C. 元素原子半径从大到小的顺序是X、Y、Z
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:3X(g)+2Y(s)![]() 2Z(g)+W(g) △H>0,下列叙述错误的是
2Z(g)+W(g) △H>0,下列叙述错误的是
A. 升高温度,正逆反应速率都增大
B. 若单位时间内每消耗3molX的同时消耗2molZ,则反应达到化学平衡状态
C. 适当增大压强,化学平衡不发生移动
D. 平衡时,X与W的物质的量浓度之比一定为3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com