
【题目】微量元素在生物体内的含量虽然很少,但在维持正常生命活动中不可缺少。这种说法可通过下面的哪一实例得到证实( )
A.植物缺镁时叶片变黄
B.油菜缺硼时只开花不结果
C.动物血液中钙盐的含量太低,容易发生抽搐
D.缺磷时会影响ATP的合成
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
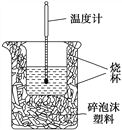
(1)该图中有两处未画出,它们是__________、__________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中所测出的“中和热”将______(填“偏大”“偏小”或“不变”);原因是_________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
(5)取50mL 0.5mol/LNaOH溶液和30mL 0.5mol/L硫酸进行实验,实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.1 | 26.3 | 26.2 | 30.5 | |
2 | 27.0 | 27.4 | 27.2 | 34.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.0 | |
酸碱溶液的密度均近似为1g/mL,中和后溶液的比热容c =4.18J/(g·℃)。则根据表中数据计算中和热△H 为_________________
(6)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L -130 mL硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,不正确的是
A. 稳定性:CH4>NH3 B. 碱性:NaOH>Mg(OH)2
C. 氧化性:F2> O2 D. 酸性:HClO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.乙烯的结构简式为CH2=CH2
B.乙烯分子中6个原子共平面
C.乙烯分子的一氯代物只有一种
D.CHBr=CHBr分子中所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是
①检验自来水是否含氯离子 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸 ④白酒中是否含甲醇
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是
A.氯水,水煤气,硫酸,醋酸,干冰
B.冰醋酸,盐酸,硫酸钡,次氯酸,乙醇
C.纯碱,明矾,水玻璃,氢硫酸,三氧化硫
D.胆矾,漂白粉,氯化钾,氢氟酸,氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
反应过程中,测得不同时间H2O2的物质的量浓度如表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(1)H2O2的分解反应氧化还原反应(填“是”或“不是”).要加快该反应的速率,可采取的方法有 .
(2)该分解反应0─20min的平均反应速率v(H2O2)为molL﹣1 min﹣1 .
(3)如果反应所用的H2O2溶液为100mL,则共产生O2g.
A.0.08
B.0.16
C.1.2
D.2.4.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过
程如图:

已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、_________(填操作名称);步骤④在实验室中常将试剂置于___________(填仪器名称)中加强热。
(2)步骤③中加入热水的作用是__________________________________。
(3)步骤④中硫酸亚铁晶体(FeSO47H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式______________________________________________________________。
(4)步骤②所得到的硫酸亚铁晶体(FeSO47H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeOFeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO47H2O的物质的量应为废水中六价铬(相当于CrO3)的物质的量的__________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com