
����Ŀ��С��ͬѧ�����������������ϣ�
����ԭ���ӻ����͵��жϷ�����
(1)��ʽ��n=(����ԭ�ӵļ۵�����+��λԭ�ӵijɼ������������)/2
˵������λԭ��Ϊ��ԭ�ӻ���ԭ��ʱ���ɼ���������Ϊ0���������Ϊ��ֵʱ����ʽ��ȡ��-���ţ��������Ϊ��ֵʱ����ʽ��ȡ��+���š�
(2)����nֵ�ж��ӻ����ͣ�
��n=2ʱΪ![]() �ӻ���n=3ʱΪ
�ӻ���n=3ʱΪ![]() �ӻ���n=4ʱΪ
�ӻ���n=4ʱΪ![]() �ӻ���
�ӻ���
�����ø÷���������������![]() ֵ�����ж�����ԭ�ӵ��ӻ����͡�
ֵ�����ж�����ԭ�ӵ��ӻ����͡�
(1)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
(2)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
(3)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
(4)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
���𰸡�4 ![]() 3
3 ![]() 4
4 ![]() 3
3 ![]()
��������
����VSEPR���ۺ��ӻ���������жϷ��ӵĿռ乹�ͺ�����ԭ�ӵ��ӻ���ʽ���۲���ӶԸ���=��ԭ�Ӹ���+�µ��ӶԸ������ݴ˷������
VP=BP+LP
VP=2��sp�ӻ���
VP=3��sp2�ӻ���
VP=4��sp3�ӻ���dsp2�ӻ���
��1��NH3����ԭ�ӣ��۲���Ӷ���=3+![]() ��5-3��1��=4���ӻ���ʽsp3�����幹��Ϊ�����ͣ��ʴ�Ϊ��4��
��5-3��1��=4���ӻ���ʽsp3�����幹��Ϊ�����ͣ��ʴ�Ϊ��4��![]() ��
��
��2��NO3������ԭ�ӣ��۲���Ӷ���=3+![]() ��5+1-3��2��=3���ӻ���ʽsp2�����幹��Ϊƽ�������Σ��ʴ�Ϊ��3��sp2��
��5+1-3��2��=3���ӻ���ʽsp2�����幹��Ϊƽ�������Σ��ʴ�Ϊ��3��sp2��
��3��NH4��������ԭ�ӣ��۲���Ӷ���=4+![]() ��5-1-4��1��=4���ӻ���ʽsp3�����幹��Ϊ���������Σ��ʴ�Ϊ��4��
��5-1-4��1��=4���ӻ���ʽsp3�����幹��Ϊ���������Σ��ʴ�Ϊ��4��![]() ��
��
��4��SO2�����м۲���ӶԸ���=��������+�µ��ӶԸ���=2+![]() ��6-2��2��=3��������ԭ�Ӳ���sp2�ӻ���ΪV�νṹ���ʴ�Ϊ��3��sp2��
��6-2��2��=3��������ԭ�Ӳ���sp2�ӻ���ΪV�νṹ���ʴ�Ϊ��3��sp2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�¶��£�0.01mol/L��NaOH��Һ��0.01mol/L��������Ƚϣ�����˵����ȷ���ǣ� ��
A.����Һ��pH֮�͵���14
B.��ˮ�������c(H+)����1.0��10-12mol/L
C.��ˮ�������c(OH-)���
D.����0.01mol/L�����ỻ��ͬŨ�ȵĴ��ᣬ��ˮ�ĵ����Ӱ�첻��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ5mL�ļס��ҡ�������Һ���������Թܱڻ��������Թ��У���������������ͼ��ʾ��ʵ��������ס��ҡ�������Ͽ����ǣ� ��

ѡ�� | �� | �� | �� |
A | 1�� | ˮ | �� |
B | �屽 | Һ�� | �Ҵ� |
C | ˮ | ����ϩ | ��ˮ |
D | �Ҵ� | ���� | �������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�Ļ�ѧʽΪ![]() ����������ԭ�ӵ�����㶼������Ӧϡ������ԭ�ӵĵ��Ӳ�ṹ����ˮ��Һ�Լ��ԣ��������й�˵��������ǣ� ��
����������ԭ�ӵ�����㶼������Ӧϡ������ԭ�ӵĵ��Ӳ�ṹ����ˮ��Һ�Լ��ԣ��������й�˵��������ǣ� ��
A.![]() ���
���![]() ��N-H��
��N-H��
B.![]() �м��й��ۼ��������Ӽ���Ϊ���ӻ�����
�м��й��ۼ��������Ӽ���Ϊ���ӻ�����
C.![]() �ĵ���ʽΪ
�ĵ���ʽΪ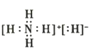
D.����ˮ��Ӧ�Ļ�ѧ����ʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ���ӵĿռ乹���������Σ���������ӵĿռ乹�������������Σ�������Ϊ( )
���ӵĿռ乹���������Σ���������ӵĿռ乹�������������Σ�������Ϊ( )
A.���ַ��ӵ�����ԭ���ӻ�������Ͳ�ͬ��![]() ��Nԭ��Ϊ
��Nԭ��Ϊ![]() �ӻ�����
�ӻ�����![]() ��Cԭ��Ϊ
��Cԭ��Ϊ![]() �ӻ�
�ӻ�
B.![]() ������Nԭ���γ������ӻ������
������Nԭ���γ������ӻ������![]() ������Cԭ���γ�4���ӻ����
������Cԭ���γ�4���ӻ����
C.![]() ��������һ��δ�ɼ��ŵ��Ӷԣ����Գɼ����ӵ��ų����ý�ǿ��
��������һ��δ�ɼ��ŵ��Ӷԣ����Գɼ����ӵ��ų����ý�ǿ��![]() �������µ��Ӷ�
�������µ��Ӷ�
D.![]() �Ǽ��Է��Ӷ�
�Ǽ��Է��Ӷ�![]() �ǷǼ��Է���
�ǷǼ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������֬�����ʺ���;���京�е�̼̼˫��(![]() )�йص���( )
)�йص���( )
A.����������֬���������������ն���֬����ά���غͺ��ܲ���
B.������֬�ڼ��������µ�ˮ������������ͺͷ���
C.ֲ����ͨ���⻯��������ֲ������(��������)
D.֬���������д�����������Ҫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�����缫���䲻ͬŨ�ȵ�����Һ��ɵĵ�س�ΪŨ���أ���������ҺŨ�Ƚ�С��һ������Ũ�Ƚϴ��һ������ͼ��ʾװ���У�X�缫��Y�缫��ʼ������ȡ� ����ʵ��ʱ���ȱպ�K2���Ͽ�K1��һ��ʱ����ٶϿ�K2���պ�K1�������γ�Ũ���أ�������ָ��ƫת�����в���ȷ����
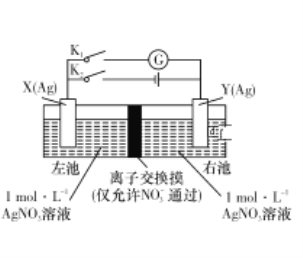
A.���ǰ���õ�����缫�����ڵ��Ʋ�
B.�ŵ�ʱ���ҳ��е�NO3-ͨ�����˽���Ĥ�������
C.���ʱ�������·ͨ��0.1 mol����ʱ�����缫��������Ϊ10.8 g
D.�ŵ�ʱ���缫YΪ��ص�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪijͬѧ��Ƶļ���Ũ�����̼��Ӧ������������ʵ��װ��ͼ������˵����ȷ����
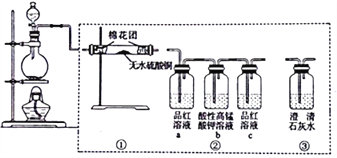
A. �����١��ۡ���˳�����ӣ��ɼ��������������
B. ��װ�â�ֻ����a��b��ͬ�����Դﵽʵ��Ŀ��
C. ��Բ����ƿ��̼�۹�������ַ�Ӧ��ָ���25�棬��Һ��pH��5.6
D. ʵ�������Ӧ���������ϡ��������ҵ�˳���жװ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ͷ�������ˮ��Һ�д�������ƽ����ϵ��SO2+H2O![]() H++HSO3�� HSO3��
H++HSO3�� HSO3��![]() H++SO32�����������Һ�У�������
H++SO32�����������Һ�У�������
A.��ˮ��SO32��Ũ������
B.ͨ������Cl2���壬��ҺpH����
C.������CaSO3��ĩ��HSO3��Ũ�Ȼ�������
D.ͨ������HCl���壬��Һ��HSO3��Ũ�ȼ�С
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com