
(12分)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y的氢化物和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
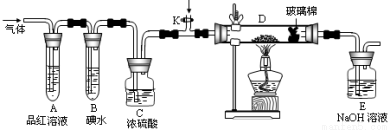
①分别通入YX2和W2,在装置 A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒(作催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒(作催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0 ×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为
×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为  。
。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A.氨水
B.稀盐酸
C.稀硝酸
D.氯化钙
E.双氧水
F.硝酸银
(12分)(每空2分)
(1)MnO2 + 4 H+ + 2Cl-
H+ + 2Cl-  Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)① 相同 产生棕褐色的烟
2SO2+O2 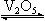 2SO3 ②5Cl2+I2+6H
2SO3 ②5Cl2+I2+6H 2O=2HIO3+10HCl
2O=2HIO3+10HCl
(3) B、D
【解析】
试题分析:(1)在中学范围内X的单质只有氧化性,且是空气的主要成份之一,则X是O元素;X和Y同主族,则Y是S元素,X、Y和W为原子序数依次递增的短周期元素,所以W是Cl元素,氯化氢与硫化氢具有相同的电子数。实验室制取氯气用二氧化锰与浓盐酸加热,反应的离子方程式为MnO2 + 4 H+ + 2Cl-
H+ + 2Cl-  Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)①二氧化硫具有漂白性,所以A中的品红溶液褪色,氯气溶于水生成的次氯酸具有强氧化性,也能使品红溶液褪色,所以A中的现象相同;足量的氯气被浓硫酸干燥后与炽热的Fe发生反应生成氯化铁,所以D处的现象是产生棕褐色的烟;当通入足量二氧化硫时,打开K通入适量氧气,则二氧化硫、氧气在催化剂、加热条件下反应生成三氧化硫,化学反应方程式为2SO2+O2 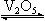 2SO3 ;
2SO3 ;
②若装置B中装有5.0mL 1.0 ×10-3mol/L的碘水,碘的物质的量是5.0×10-3L×1.0
×10-3mol/L的碘水,碘的物质的量是5.0×10-3L×1.0 ×10-3mol/L=5.0×10-6mol,当通入足量氯气完全反应后,I2被完全氧化,转移了5.0×10-5mol电子,则I元素的化合价升高5.0×10-5mol/(5.0×10-6mol×2)=5,所以I的氧化产物是HIO3,氯气被还原为氯离子,则反应的化学方程式5Cl2+I2+6H
×10-3mol/L=5.0×10-6mol,当通入足量氯气完全反应后,I2被完全氧化,转移了5.0×10-5mol电子,则I元素的化合价升高5.0×10-5mol/(5.0×10-6mol×2)=5,所以I的氧化产物是HIO3,氯气被还原为氯离子,则反应的化学方程式5Cl2+I2+6H 2O=2HIO3+10HCl;
2O=2HIO3+10HCl;
(3)因为亚硫酸的酸性比盐酸弱,所以二氧化硫与氯化钡溶液不反应。A.加入氨水后,二氧化硫与一水合氨反应生成亚硫酸铵,则亚硫酸根离子与钡离子反应生成亚硫酸钡沉淀,错误; B.加入稀盐酸 ,则溶液的酸性增强,不会产生沉淀,正确;C.加入稀硝酸后,二氧化硫被氧化为硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡白色沉淀,错误; D.氯化钙和氯化钡的性质相同,所以加入氯化钙溶液后也不会产生沉淀,正确;E.双氧水具有强氧化性,可以氧化二氧化硫为硫酸根离子,所以有硫酸钡沉淀产生,错误;F.加入硝酸银,则氯离子与银离子反应生成氯化银沉淀,错误,答案选BD。
考点:考查元素的推断,物质性质的应用,二氧化硫、氯气的化学性质的检验,化学方程式的判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015湖南省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列反应中,能用H++OH-=H2O表示的是
A.NaOH溶液和CO2的反应 B.Ba(OH)2溶液和稀H2SO4的反应
C.NaOH溶液和盐酸反应 D.氨水和稀H2SO4的反应
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
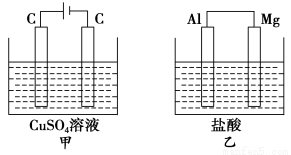
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-===Cu,乙中负极为Mg-2e-===Mg2+
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
理论上不能用于设计成原电池的反应是
A.2H2(g)+O2(g)==2H2O(l) △H<0
B.HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) △H<0
C.2Al(s)+3Cl2(g)==2AlCl3(s) △H<0
D.Zn(s)+2HCl(aq)==ZnCl2+H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
常温下,不可能与NaHCO3溶液反应生成气体的物质是
A.酸 B.碱 C.盐 D.氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
Al、Fe、Cu都是重要的金属元素,下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制 备AlCl3、FeCl3、CuCl2固体均不能采用将溶液
备AlCl3、FeCl3、CuCl2固体均不能采用将溶液 直接蒸干的方法
直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2 的混合溶液时阴极上依次析出Cu、Fe、Al
的混合溶液时阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
(14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
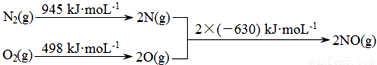
则该反应的热化学方程式为 。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx == 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积 L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g);△H= -b kJ?mol-1
CH3OH(g);△H= -b kJ?mol-1
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
③经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正 v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com