
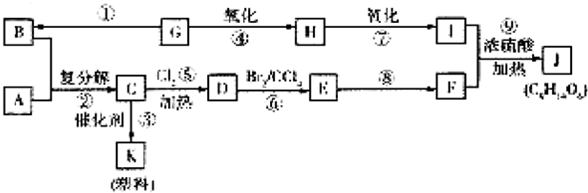
 +Br2$\stackrel{CCl_{4}}{��}$
+Br2$\stackrel{CCl_{4}}{��}$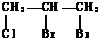 ��
�� ��
�� ���� ��Ԫ��F�ķ���ʽΪC3H8O3���ں˴Ź�������ͼ�з�ֵ��Ϊ4��2��1��1����FΪHOCH2CH��OH��CH2OH����G��H��I��������������Ӧ����֪GΪ����HΪȩ��IΪ���ᣬI��F��Ӧ����J��Ӧ�Ƿ���������Ӧ�����J�ķ���ʽ��֪�䲻���Ͷ�Ϊ3��Ӧ����3����������IΪCH3COOH����GΪCH3CH2OH��HΪCH3CHO��JΪ ��A��B������Ϣϩ���ĸ��ֽⷴӦ�õ�C����BΪCH3CH=CH2��C��D��E��F�к���̼ԭ����Ŀ��ȣ�A���ӵ�����̼ԭ��һ����������˳���칹�壬��AΪCH3CH=CHCH3��CΪCH2=CHCH3��DΪCH2=CHCH2Cl��EΪBrCH2CHBrCH2Cl��C��K�����Ӿ۷�Ӧ����KΪ�۱�ϩ���ݴ˽��н��
��A��B������Ϣϩ���ĸ��ֽⷴӦ�õ�C����BΪCH3CH=CH2��C��D��E��F�к���̼ԭ����Ŀ��ȣ�A���ӵ�����̼ԭ��һ����������˳���칹�壬��AΪCH3CH=CHCH3��CΪCH2=CHCH3��DΪCH2=CHCH2Cl��EΪBrCH2CHBrCH2Cl��C��K�����Ӿ۷�Ӧ����KΪ�۱�ϩ���ݴ˽��н��
��� �⣺��Ԫ��F�ķ���ʽΪC3H8O3���ں˴Ź�������ͼ�з�ֵ��Ϊ4��2��1��1����FΪHOCH2CH��OH��CH2OH����G��H��I��������������Ӧ����֪GΪ����HΪȩ��IΪ���ᣬI��F��Ӧ����J��Ӧ�Ƿ���������Ӧ�����J�ķ���ʽ��֪�䲻���Ͷ�Ϊ3��Ӧ����3����������IΪCH3COOH����GΪCH3CH2OH��HΪCH3CHO��JΪ ��A��B������Ϣϩ���ĸ��ֽⷴӦ�õ�C����BΪCH3CH=CH2��C��D��E��F�к���̼ԭ����Ŀ��ȣ�A���ӵ�����̼ԭ��һ����������˳���칹�壬��AΪCH3CH=CHCH3��CΪCH2=CHCH3��DΪCH2=CHCH2Cl��EΪBrCH2CHBrCH2Cl��C��K�����Ӿ۷�Ӧ����KΪ�۱�ϩ��
��A��B������Ϣϩ���ĸ��ֽⷴӦ�õ�C����BΪCH3CH=CH2��C��D��E��F�к���̼ԭ����Ŀ��ȣ�A���ӵ�����̼ԭ��һ����������˳���칹�壬��AΪCH3CH=CHCH3��CΪCH2=CHCH3��DΪCH2=CHCH2Cl��EΪBrCH2CHBrCH2Cl��C��K�����Ӿ۷�Ӧ����KΪ�۱�ϩ��
��1��������������֪��F�Ľṹ��ʽΪ��HOCH2CH��OH��CH2OH��JΪ ���������������������
���������������������
�ʴ�Ϊ��HOCH2CH��OH��CH2OH���������������
��2������ϩ���ĸ��ֽ�ԭ����֪����Ӧ������ȡ����Ӧ����Ӧ�ݷ�Ӧ������ȡ����Ӧ����Ӧ��������ǣ���������ˮ��Һ�����ȣ�
�ʴ�Ϊ��ȡ����Ӧ����������ˮ��Һ�����ȣ�
��3��AΪCH3CH=CHCH3��ͬ���칹��ΪCH2=CHCH2CH3��CH2=C��CH3��2��A��ͬ���칹��ͨ��ϩ�����ֽⷴӦ���γɵ���ϩ���У�CH2=CH2��CH3CH2CH=CHCH2CH3��CH3CH2CH=C��CH3��2�� ������4�֣�
������4�֣�
�ʴ�Ϊ��4��
��4����Ӧ�ٵĻ�ѧ����ʽΪ��CH3CH2OH $��_{170��}^{Ũ����}$CH2 �TCH2��+H2O����Ӧ�Ļ�ѧ����ʽΪ�� +Br2$\stackrel{CCl_{4}}{��}$
+Br2$\stackrel{CCl_{4}}{��}$ ��
��
�ʴ�Ϊ��CH3CH2OH $��_{170��}^{Ũ����}$CH2 �TCH2��+H2O�� +Br2$\stackrel{CCl_{4}}{��}$
+Br2$\stackrel{CCl_{4}}{��}$ ��
��
��5���л���W�ķ���ʽ��I��CH3COOH�����Ӷ�2����CH2�����ܷ���ˮ�ⷴӦ��������Ӧ��Ϊ�����γɵ�����W�Ľṹ��ʽ�����ǣ�HCOO-CH2-CH2-CH3��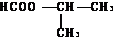 ��
��
�ʴ�Ϊ��HCOO-CH2-CH2-CH3��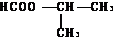 ��
��
���� ���⿼���л�����ƶϣ���Ŀ�Ѷ��еȣ���Ҫ����ϩ���ĸ��ֽⷴӦԭ�����������ã����չ����ŵ����ʽ�Ϸ�Ӧ���������ƶϣ������ֿ���ѧ���ķ������������������Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1.6 g�����к���6.02��1022����ԭ�� | |
| B�� | ��״���£�2.24 Lˮ�к���6.02��1022��ˮ���� | |
| C�� | 2.24 L���������к�6.02��1023������ | |
| D�� | 2.4 g����þ��Ϊþ����ʱʧȥ6.02��1022������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ŀ | B�� | �¶� | C�� | ѹǿ | D�� | ����ֱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�11.2L ���麬�еķ�����Ϊ0.5NA | |
| B�� | 1 mol �ǻ���-OH�����еĵ�����Ϊ10NA | |
| C�� | 1 mol �����μӷ�Ӧʱ������ת����Ŀһ��Ϊ2NA | |
| D�� | 10 g H218O ���е�������Ϊ5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ӵ��������� | B�� | ��°��ƴ��� | ||
| C�� | ��ͭ���� | D�� | ʯ�͵��ѻ����ѽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 78g������C=C˫������ĿΪ3NA | |
| B�� | 1L 0.1mol/L��NaClO��Һ�к���ClO-����ĿΪ0.1NA | |
| C�� | ���³�ѹ�£�14g��N2��CO��ɵĻ�����庬�е�ԭ����ΪNA | |
| D�� | ��״���£�6.72L NO2��ˮ��Ӧת�Ƶ�����Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ����������Cu��Cu2O�����ʵ���֮��Ϊ1��1 | |
| B�� | ԭϡ������HNO3�����ʵ���Ũ��Ϊ1.3mol•L-l | |
| C�� | ������NO�����Ϊ2.24L | |
| D�� | Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+��Fe2+��SO42-��NO3- | B�� | Mg2+��K+��Cl-��AlO2- | ||
| C�� | Al3+��Na+��SO42-��HS- | D�� | Ca2+��H+��NO3-��SO32- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com