
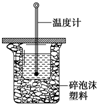
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

科目:高中化学 来源: 题型:
| A、NaHCO3溶液中存在:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
| B、室温下,向0.01mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、Na2CO3溶液:c(OH-)+c(HCO3-)=c(H+)+2c(H2CO3) |
| D、25℃时,Al(OH)3固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/LNH4Cl溶液中的Ksp小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、磺化、硝化、风化、钝化都是化学变化 |
| B、蒸馏、干馏、常压分馏、减压分馏、都是物理变化 |
| C、甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰 |
| D、水煤气、裂解气、焦炉气、天然气都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知
中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知 查看答案和解析>>
科目:高中化学 来源: 题型:
 根据中和热的测定实验填空.
根据中和热的测定实验填空.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用通入O2的方法来除去NO2中少量的NO |
| B、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| C、向试管中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明原溶液中无NH4+ |
| D、由于KNO3和KCl的溶解度随温度的变化差异较大,所以用重结晶的方法可除去KNO3固体中少量的KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com