
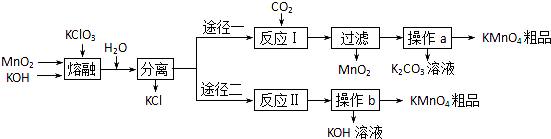
 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O| 温度 | 溶解度/g | ||
| K2CO3 | KOH | KMnO4 | |
| 20℃ | 111 | 112 | 6.38 |
| 60℃ | 127 | 154 | 22.1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
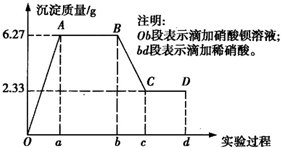 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com