
 CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
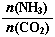 ��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ��
��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ��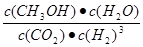 ���ڣ� �� ��>
���ڣ� �� ��> CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O
CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O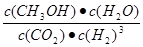 �����ɼ״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵͼʾ��֪������Ӧ�ﵽƽ��������¶ȣ��״������������С��˵�������¶ȣ���ѧƽ�������ƶ�������ƫ���ƶ�ԭ���������¶��λ�����ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ�����Ԧ�H<0�� �����ߢ��I�ȴﵽƽ�⡣˵���¶��¶����ߢ�>I�������¶ȸߣ�CH3OH�����ͣ�˵����ѧƽ�ⳣ��K��>K������3���ٸ��������غ㶨�ɣ���CO2��NH3��һ�������ºϳ�����[CO(NH2)2]�ķ�Ӧ����ʽΪ2NH3+CO2
�����ɼ״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵͼʾ��֪������Ӧ�ﵽƽ��������¶ȣ��״������������С��˵�������¶ȣ���ѧƽ�������ƶ�������ƫ���ƶ�ԭ���������¶��λ�����ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ�����Ԧ�H<0�� �����ߢ��I�ȴﵽƽ�⡣˵���¶��¶����ߢ�>I�������¶ȸߣ�CH3OH�����ͣ�˵����ѧƽ�ⳣ��K��>K������3���ٸ��������غ㶨�ɣ���CO2��NH3��һ�������ºϳ�����[CO(NH2)2]�ķ�Ӧ����ʽΪ2NH3+CO2 CO(NH2)2+H2O��
CO(NH2)2+H2O��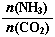 ��3������n(CO2)=amol,��n(NH3)=3amol�����ڴ�ƽ��ʱCO2��ת����Ϊ60%�����Է�Ӧ���ĵ�n(CO2)=0��6amol�������ݷ���ʽ�ж��ߵ����ʵ����Ĺ�ϵ��֪��Ӧ��NH3�����ʵ���n(NH3)=1��2amol����������ת����Ϊ(1��2amol����3amol)��100%=40%������������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬���������ɵã��õ缫��Ӧ�ķ���ʽΪCO2+8e��+8H+=CH4+2H2O��
��3������n(CO2)=amol,��n(NH3)=3amol�����ڴ�ƽ��ʱCO2��ת����Ϊ60%�����Է�Ӧ���ĵ�n(CO2)=0��6amol�������ݷ���ʽ�ж��ߵ����ʵ����Ĺ�ϵ��֪��Ӧ��NH3�����ʵ���n(NH3)=1��2amol����������ת����Ϊ(1��2amol����3amol)��100%=40%������������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬���������ɵã��õ缫��Ӧ�ķ���ʽΪCO2+8e��+8H+=CH4+2H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��g����
��g���� ��g��+H2��g������H=" +117.6" kJ/mol
��g��+H2��g������H=" +117.6" kJ/mol| A����Ϊ�÷�Ӧ�����ȷ�Ӧ�����������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С�� |
| B������������1molCO2��1mol H2��ƽ��������Ӧ�����ƶ��� |
| C��������ͨ��1mol CO2��ƽ��������Ӧ�����ƶ���CO2��ת�������� |
| D��ѹ�������ƽ�ⲻ�ƶ�����Ӧ��Ͳ����Ũ�ȶ����䣻 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 һ��ʱ���ﵽ��ѧƽ��״̬���ı�ijһ����������˵����ȷ����
һ��ʱ���ﵽ��ѧƽ��״̬���ı�ijһ����������˵����ȷ����| A���������¶ȣ���Ӧ��������ܶȲ���ʱ���ﵽ��ƽ��״̬ |
| B��������B��Ũ�ȣ���H��С |
| C����ʹ���ʵ�������A��ת�������� |
| D��������ѹǿ��ƽ�������ƶ�����m+n>p+q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3�����ж���ȷ����
2SO3�����ж���ȷ����| A��2 mol SO2��������O2��Ӧ��������2 mol SO3 |
| B��ƽ��ʱSO2��O2��SO3�ķ�����֮��Ϊ2��1��2 |
| C��ƽ��ʱSO2���������ʱض�����O2���������ʵ�2�� |
| D��ƽ��ʱSO2��Ũ�ȱ�ΪO2Ũ�ȵ�2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 N2O3 + O2��N2O3�ֿɰ����зֽ⣺ N2O3
N2O3 + O2��N2O3�ֿɰ����зֽ⣺ N2O3 N2O + O2���� 4 molN2O5����һ���ܱ������У������� t��ʱ��Ӧ�ﵽ��ƽ��״̬��ƽ��ʱ��c��O2��=" 4.5" mol/L, c��N2O3��=" 1.62" mol/L,c��N2O��= mol/L����ʱN2O5�ķֽ���Ϊ ��
N2O + O2���� 4 molN2O5����һ���ܱ������У������� t��ʱ��Ӧ�ﵽ��ƽ��״̬��ƽ��ʱ��c��O2��=" 4.5" mol/L, c��N2O3��=" 1.62" mol/L,c��N2O��= mol/L����ʱN2O5�ķֽ���Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)����ҵ��������CO����ȼ�ϼ״���
CH3OH(g)����ҵ��������CO����ȼ�ϼ״���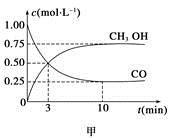 ��
�� 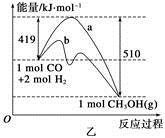
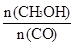 �������____________��
�������____________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Ni(CO)4(g)
Ni(CO)4(g)| �¶ȡ� | 25 | 80 | 230 |
| ƽ�ⳣ�� | 5��10��4 | 2 | 1.9��10��5 |
 Ni(s)��4CO(g)��ƽ�ⳣ����0.5
Ni(s)��4CO(g)��ƽ�ⳣ����0.5�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 NaCl(l)+ K(g)ѡ���˵��¶�,ʹK�������ӷ�Ӧ������з������
NaCl(l)+ K(g)ѡ���˵��¶�,ʹK�������ӷ�Ӧ������з������ | A���ڢۢ� | B���٢ۢ� | C���٢ڢۢܢ� | D���٢ڢۢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com