
【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 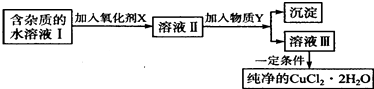
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .
【答案】
(1)C
(2)AC
(3)蒸发浓缩;冷却结晶
(4)酸式;MnO4﹣+8H++5Fe2+=Mn2++5Fe3++4H2O
【解析】解:(1)根据实验目的,加入氧化剂的目的是将Fe2+氧化成Fe3+ , 便于生成Fe(OH)3沉淀而与Cu2+分离,K2Cr2O7、NaClO、H2O2、KMnO4都具有氧化性,能将亚铁离子氧化,但是K2Cr2O7、NaClO、KMnO4能引进新的杂质离子,双氧水是绿色氧化剂,得到的还原产物是水,不会引进杂质离子, 所以答案是:C;(2)加入的物质Y可调节,使Fe3+全部沉淀,同时不引进新杂质,铁离子在水中存在水解平衡:Fe3++3H2OFe(OH)3+3H+ , 用Cu(OH)2、CuCO3、CuO、Cu2(OH)2CO3等,
中和溶液的酸性,能促进水解平衡向正反应方向移动,调节pH,可以将铁离子沉淀(Fe3+氢氧化物完全沉淀时的PH:3.2),同时引入铜离子,无新的金属离子引入,且铜离子不沉淀(Cu2+氢氧化物开始沉淀时的PH:4.7),氢氧化钠和氨气都能使铜离子沉淀,无法分离Fe3+、Cu2+ ,
所以答案是:AC;(3)结晶水合物,为防止结晶水散失,从溶液中获得晶体通常采用降温结晶,所以从溶液中获得氯化铜晶体(CuCl22H20)要经过蒸发浓缩、冷却结晶、过滤三步操作,
所以答案是:蒸发浓缩;冷却结晶;(4)KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的胶管,所以选择酸式滴定管,测定溶液Ⅰ中Fe2+的浓度,用KMnO4标准溶液滴定,Fe2+与MnO4﹣反应,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子守恒、电荷守恒、原子守恒可知,离子反应为MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O,
所以答案是:酸式;MnO4﹣+8H++5Fe2+=Mn2++5Fe3++4H2O.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z , 研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( ) 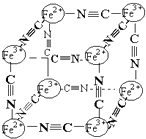
A.该晶体是原子晶体
B.M的离子位于上述立方体的面心,呈+2价
C.M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50%
D.晶体的化学式可表示为MFe2(CN)3 , 且M为+1价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是 )
A. 植物油的主要成分是高级脂肪酸
B. 将煤间接液化可合成液体燃料甲醇,该过程是化学变化
C. 葡萄糖和果糖、淀粉和纤维素分别互为同分异构体
D. 苯、油脂均不能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请根据如下实验方案回答问题. 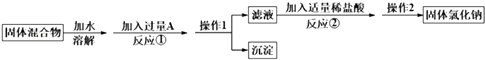
(1)A物质的化学式为;操作1的名称是 .
(2)反应①中加入略过量的A物质的目的是;判断A已过量的实验操作方法是 .
(3)写出反应②的化学方程式: . 如果加入盐酸过量,则对所得到的氯化钠的纯度(填“有”或“没有”)影响.
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2molL-1的氢氟酸中滴加0.2molL-1的NaOH溶液时,溶液的pH变化如图所示。

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____,电离度α(HF)为______%。
(3)下列有关图中各点微粒浓度关系正确的是________。
a.在A处溶液中:c(F—)+c(HF)=0.2 molL-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序 ___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日前中国量子物质科学协同创新中心的江颖课题组和王恩哥课题组合作,在水科学领域取得重大突破,在国际上首次实现了水分子的亚分子级分辨成像,使得解析水的氢键网络构型成为可能.(图a是实验器件示意图,图b是拍摄到的图片的一部分,图c是图b所对应的结构示意图)下列有关说法不正确的是( ) 
A.图a所示实验器件中,用氯化钠作为绝缘薄膜层,是因为氯化钠晶体不导电
B.图b是表示一个H2O分子内部的氢键和氢氧共价键结构特征示意图
C.水分子间形成氢键使水的熔点和沸点升高
D.H2O分子的稳定性很强,是因为分子内氢氧共价键强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.HClO的结构式:H﹣Cl﹣O
B.Na2O2的电子式: ![]()
C.中子数为20的氯原子: ![]() Cl
Cl
D.铝原子的结构示意图 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 ![]() 滴加
滴加 ![]() 白色沉淀滴加
白色沉淀滴加 ![]() 沉淀不溶解﹣→说明试样已变质
沉淀不溶解﹣→说明试样已变质
B.除去粗盐中硫酸钙杂质:粗盐 ![]() 足量
足量 ![]() 足量
足量 ![]() 溶液
溶液 ![]() 滤液中
滤液中 ![]() 盐酸
盐酸 ![]() 精盐
精盐
C.检验某溶液中是否含有Fe2+试样 ![]() 溶液颜色无变化
溶液颜色无变化 ![]() 溶液变红色﹣→溶液中含有Fe2+
溶液变红色﹣→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液30% ![]() 稀硝酸
稀硝酸 ![]() 溶液变蓝色﹣→氧化性:H2O2>I2
溶液变蓝色﹣→氧化性:H2O2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的好似( )
A.已知2H2O(l)═2H2(g)+O2(g)△H=+571.6KJmol﹣1 , 无法求H2的燃烧热
B.已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性
C.已知500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出19.3KJ的热量,无法推出该反应的热化学方程式
D.已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2 , 无法得出△H2>△H1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com