
【题目】下表数据是对应物质的熔点:
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
熔点℃ | 920 | 801 | 1291 | 160 | -107 | 2072 | -57 | 1723 |
(1)上述涉及原子中最活泼非金属原子核外电子排布式是________________;某阴离子的轨道表示式为![]() ,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
(2)物质①的电子式:____________,⑦的结构式:_______________。
(3)④溶于水溶液呈酸性,用离子方程式表示其原因_______________________________;若把其溶液加热蒸干并灼烧,得到的固体是_______________。
(4)不能用于比较Na与Al金属性相对强弱的事实是_________________。
A.最高价氧化物对应水化物的碱性 B.Na最外层1个电子而Al 最外层3个电子
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(5)⑧比⑦熔点高出很多,其理由是:_____________________________;①和②都属于离子晶体,但①比②的熔点高,请解释原因____________________________。
【答案】1s22s22p5 5 3 10 ![]() O=C=O Al3++3H2O
O=C=O Al3++3H2O![]() Al(OH)3+3H+ Al2O3 B ⑧(SiO2)是原子晶体⑦(CO2) 是分子晶体 氧离子半径比氯离子半径小且氧离子带2个电荷,故①的离子键比②强,熔点比②高
Al(OH)3+3H+ Al2O3 B ⑧(SiO2)是原子晶体⑦(CO2) 是分子晶体 氧离子半径比氯离子半径小且氧离子带2个电荷,故①的离子键比②强,熔点比②高
【解析】
(1)上述涉及的原子中最活泼非金属非金属是F元素,其原子核外电子排布式是1s22s22p5;由某阴离子的轨道表示式![]() 可知,其核外电子占有的轨道总数是5个、共有3种能量不同的轨道,因为同一轨道内电子的能量相同,所以其有3种能量不同的电子;同一原子的核外的不同电子的运动状态是不同的,所以其共有10种不同运动状态的电子。
可知,其核外电子占有的轨道总数是5个、共有3种能量不同的轨道,因为同一轨道内电子的能量相同,所以其有3种能量不同的电子;同一原子的核外的不同电子的运动状态是不同的,所以其共有10种不同运动状态的电子。
(2)物质①是离子化合物,其电子式为![]() ,⑦是共价化合物,其结构式为O=C=O。
,⑦是共价化合物,其结构式为O=C=O。
(3)④溶于水溶液呈酸性,是因为铝离子发生水解,其离子方程式为Al3++3H2O![]() Al(OH)3+3H+;由于水解产物盐酸易挥发,若把其溶液加热蒸干并灼烧,水解产物氢氧化铝受热分解,故得到的固体是Al2O3。
Al(OH)3+3H+;由于水解产物盐酸易挥发,若把其溶液加热蒸干并灼烧,水解产物氢氧化铝受热分解,故得到的固体是Al2O3。
(4)A.最高价氧化物对应水化物的碱性越强则其金属性越强;B.Na最外层1个电子而Al 最外层3个电子,这与金属性的强弱没有必然的关系;C.单质与H2O反应的难易程度 ,越容易置换出氢气,金属性越强;D.比较同浓度NaCl和AlCl3的pH值,pH越大的,说明其最高价氧化物的水化物的碱性越强,则其金属性越强。综上所述,不能用于比较Na与Al金属性相对强弱的事实是B。
(5)⑧比⑦熔点高出很多,其理由是:两者的晶体类型不同,⑧(SiO2)是原子晶体,而⑦(CO2) 是分子晶体;①和②都属于离子晶体,但①比②的熔点高,其原因是:氧离子半径比氯离子半径小且氧离子带2个电荷,故①的离子键比②强,其晶格能较高,所以熔点比②高。


科目:高中化学 来源: 题型:
【题目】汽车尾气净化的主要原理为:2NO+2CO![]() N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
A. 在单位时间内生成1mol CO2的同时消耗了lmol CO
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变
D. 相同时间内,形成CO2分子内键的数目是断开N2分子内键的数目的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A原子的质量为ag,12C原子的质量为bg,NA为阿伏加德罗常数,下列说法正确的是( )
A. A元素的相对原子质量为12a/bB. mgA原子的物质的量为(m/aNA)mol
C. 该原子的摩尔质量为aNAgD. ng该A原子所含的中子数与质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。

(1)②、⑥、⑧的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____ (用化学式表示)。
(3)As的原子结构示意图为_________其氢化物的化学式为__________;
(4)Y由②、⑥、⑧三种元索组成,它的水溶液是生活中常见的消毒剂。As 可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为__________,当消耗l mol还原剂时,电子转移了_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是
A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有的同学根据组成或性质将Na2CO3、NaOH、NaCl划分为一类。下列选项中的物质根据分类依据(后者是分类依据)能与上述三种物质归为一类的是
A.NaNO3(都属于钠盐)B.CuSO4(都易溶于水)
C.KNO3(都能与AgNO3溶液反应)D.KMnO4(固态时均为白色)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬合金有重要的用途,从其废料中制取铬的流程如下:
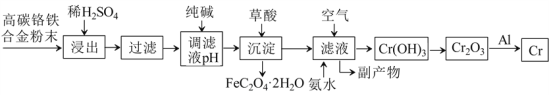
已知: ① Cr+H2SO4=CrSO4+H2↑,
② 流程中铬元素浸出之后至生成Cr(OH)3之间均以自由移动离子状态存在于溶液中。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有:________________________ (写一条即可) 。
(2)用纯碱调节滤液pH,得到某弱碱沉淀,若纯碱过量,则可能导致的后果是_:_____________。
(3)流程中的“副产物”中,可用作可溶性钡盐中毒解毒剂的物质的化学式是___________;可用作化肥的物质的化学式是_____________。
(4)加入草酸实现沉淀转化反应化学方程式为:_______________________________________。
(5)流程中利用铝热反应冶炼铬的化学方程式为:_____________________________________。
(6)流程中由滤液生成Cr(OH)3的化学方程式为:_____________________________________。
(7)除已知反应①之外,整个流程中涉及的主要氧化还原反应有_____个,分解反应有____个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com