
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z的单质是空气的主要成分,W的原子半径在同周期中最小。请回答下列问题:

(1)写出化合物XWZ的电子式:_______________________。
(2)由W、Y两种元素组成的一种化合物M分子中,每个原子最外层均达到稀有气体的稳定结构,在工业生产中M大规模用于面粉的漂白和杀菌,写出M与水反应的化学方程式:________________。
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物N是一种常见的化肥,若N能促进水的电离,则其化学式为____________________;若N能抑制水的电离,则其化学式为___________________。
(4)XYZ3溶液的酸性比XWZ溶液的酸性强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________________________________。
(1)XWZ的电子式为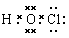 (2分)
(2分)
(2)NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O)(2分)
(3)NH4NO3(或NH4Cl)(1分);NH3·H2O(1分)
(4)不正确;HClO不是Cl的最高价氧化物对应的水化物(2分)
【解析】
试题分析:有题意可知Y为N,Z为O,由原子序数:X<Y,原子半径:X<Y,故X为H。由原子序数:Z<W,原子半径:Z<W,且W的原子半径是同周期中最小。故W是Cl。(1)XWZ的电子式为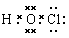 ,(2)由题意可知M为NCl3,其与水反应应生成HClO,故方程式为:NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O);(3)化合物N由三种元素组成的常见化肥,故应含有N,能促进水解的应为铵盐,为NH4NO3或NH4Cl;能抑制水解的应为NH3·H2O。(4)HClO不是Cl的最高价氧化物对应的水化物,故不正确。
,(2)由题意可知M为NCl3,其与水反应应生成HClO,故方程式为:NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O);(3)化合物N由三种元素组成的常见化肥,故应含有N,能促进水解的应为铵盐,为NH4NO3或NH4Cl;能抑制水解的应为NH3·H2O。(4)HClO不是Cl的最高价氧化物对应的水化物,故不正确。
考点:考查原子结构、化学用语、化合物的性质等知识点。


科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
(2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)

查看答案和解析>>
科目:高中化学 来源: 题型:
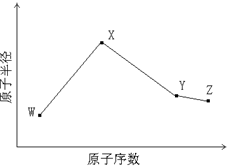 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com