
分析 设R的相对原子质量为M,最高正价为x,所以它的氢化物的化学式为H(8-x)R,它的最高价氧化物的化学式为R2Ox或RO${\;}_{\frac{x}{2}}$,于是有:$\left\{\begin{array}{l}{\frac{8-x}{M+8-x}=2.47%}\\{\frac{16x}{2M+16x}=37.8%}\end{array}\right.$,解得x=6,M=79,所以R为Se元素,据此解答.
解答 解:(1)设R的相对原子质量为M,最高正价为x,所以它的氢化物的化学式为H(8-x)R,它的最高价氧化物的化学式为R2Ox或RO${\;}_{\frac{x}{2}}$,于是有:$\left\{\begin{array}{l}{\frac{8-x}{M+8-x}=2.47%}\\{\frac{16x}{2M+16x}=37.8%}\end{array}\right.$,解得x=6,M=79,
答:元素R的相对原子质量为79.
(2)由(1)中R元素相对原子质量为79,可知R为Se元素,氢化物为H2Se,其电子式为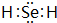 ,
,
答:R元素气态氢化物的电子式为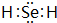 .
.
(3)R为Se元素,最高价为+6价,其最高价氧化物对应水化物的化学式为H2SeO4,属于酸,
答:R的最高价氧化物对应水化物的化学式为H2RO4,属于酸.
点评 本题考查结构性质位置关系,计算推断元素是解题关键,有利于基础知识的巩固.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
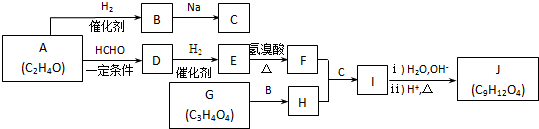
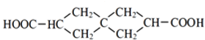 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式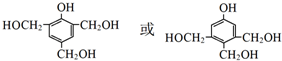 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 早在1000多年前,我国就已采用加热胆矾(CuSO4•5H2O)或绿矾(FeSO4•7H2O) 的方法制硫酸,尽管硫酸的生产工艺几经改进,此方法仍然是工业生产硫酸的主要方法 | |
| B. | 氢能是未来能源结构中最具发展潜力的清洁能源之一.目前已有专家已研究出用淀粉或纤维素与水在酶作用下转变为二氧化碳和氢气的方法制氢气.从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| C. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH$\stackrel{Pd}{→}$CH2=C(CH3) COOCH3,其过程符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
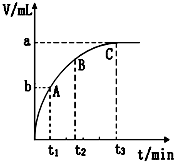 某课外兴趣小组对H2O2的分解速率做了如下实验探究.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维中所用材料为晶体硅 | |
| B. | SiO2是酸性氧化物,所以不与任何酸反应 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.
.实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com