
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
| Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中SO3的浓度小于0.022 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中SO3的浓度大于0.044 mol•L-1 | |
| D. | 若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,则反应向逆反应方向进行 |
分析 A.结合v=$\frac{△c}{△t}$计算;
B.I与Ⅱ温度相同,I中起始量为II中2倍,该反应为气体体积减小的反应,增大压强平衡正向移动;
B.I与Ⅲ起始量相同,该反应为放热反应,升高温度平衡逆向移动;
D.2SO2(g)+O2(g)?2SO3(g)
开始 0.2 0.1 0
转化 0.044 0.022 0.044
平衡 0.156 0.078 0.044
K=$\frac{0.04{4}^{2}}{0.078×0.15{6}^{2}}$=1.02,
若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,Qc=$\frac{0.0{2}^{2}}{0.0{2}^{2}×0.01}$=100>K,以此来解答.
解答 解:A.从开始至平衡时,时间未知,不能计算容器Ⅰ中SO3的反应速率,故A错误;
B.I与Ⅱ温度相同,I中起始量为II中2倍,该反应为气体体积减小的反应,增大压强平衡正向移动,则平衡时,容器Ⅱ中SO3的浓度小于0.022 mol•L-1,故B正确;
B.I与Ⅲ起始量相同,该反应为放热反应,升高温度平衡逆向移动,则平衡时,容器Ⅲ中SO3的浓度小于0.044 mol•L-1,故C错误;
D.2SO2(g)+O2(g)?2SO3(g)
开始 0.2 0.1 0
转化 0.044 0.022 0.044
平衡 0.156 0.078 0.044
K=$\frac{0.04{4}^{2}}{0.078×0.15{6}^{2}}$=1.02,
若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,Qc=$\frac{0.0{2}^{2}}{0.0{2}^{2}×0.01}$=100>K,则反应向逆反应方向进行,故D正确;
故选BD.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据应用、化学平衡三段法、Qc与K的计算为解答的关键,侧重分析与计算能力的考查,注意平衡移动原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 0.1 mol/L CH3COOH 溶液中加入少量水,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 将 CH3COONa 溶液从 25℃升温至 40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向硝酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{O}_{3}^{-})}$<1 | |
| D. | 向 AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
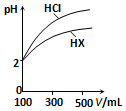 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属活泼性铜比铁弱.可在铁船闸上装铜块减缓其腐蚀 | |
| B. | MgO的熔点很高,可用于制作耐高温材科 | |
| C. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 | |
| D. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
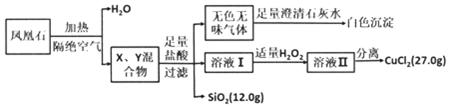
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H35Cl、H37Cl属于同素异形体 | |
| B. | 稳定性:CH4>SiH4;还原性:HCl>H2S | |
| C. | 16O与 18O的中子数不同,核外电子排布却相同 | |
| D. | K+、Ca2+、Mg2+的离子半径依次增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com