
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
分析 还原性:SO32->I-.向含有amolKI和amolK2SO3的混合液中通入bmolCl2充分反应,故氯气先和SO32-反应,当SO32-反应完全后,氯气再和I-反应.而amolK2SO3完全反应时能消耗amol氯气,amolKI完全反应时能消耗$\frac{a}{2}$mol氯气.即当amolKI和amolK2SO3完全反应时,共消耗1.5amol氯气.
A、当a≥b时,氯气的量不足,只能氧化SO32-为硫酸根;
B、当5a=4b即a=0.8b时,0.8bmolSO32-消耗0.8bmol氯气,剩余的0.2bmol氯气能氧化0.4bmolI-为I2,据此分析;
C、当a≤b≤1.5a时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应;
D、当a<b<1.5a时,SO32-全部被氧化为硫酸根,而I-不能全部被氧化.
解答 解:还原性:SO32->I-.向含有amolKI和amolK2SO3的混合液中通入bmolCl2充分反应,故氯气先和SO32-反应,当SO32-反应完全后,氯气再和I-反应.而amolK2SO3完全反应时能消耗amol氯气,amolKI完全反应时能消耗$\frac{a}{2}$mol氯气.即当amolKI和amolK2SO3完全反应时,共消耗1.5amol氯气.
A、当a≥b时,氯气的量不足,只能氧化SO32-为硫酸根,氯气被还原为氯离子,故离子方程式为SO32-+Cl2+H2O=SO42-+2H++2Cl-,故A正确;
B、当5a=4b即a=0.8b时,0.8bmolSO32-消耗0.8bmol氯气,被氧化为0.8bmolSO42-,0.2bmol氯气能氧化0.4bmolI-为I2,故离子方程式为:4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-,故B正确;
C、当a≤b≤1.5a时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应,故转移的电子的物质的量为2mol≤n(e-)≤3amol,故C错误;
D、当a<b<1.5a时,SO32-全部被氧化为硫酸根,而I-不能全部被氧化,故溶液中硫酸根的物质的量为amol,消耗的氯气为amol,故剩余的氯气为(b-a)mol,则能氧化的电离子的物质的量为2(b-a)mol,故溶液中的碘离子的物质的量为a-2(b-a)=(3a-b)mol,由于氯气完全反应,故溶液中的氯离子的物质的量为2bmol,故溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b,故D正确.
故选C.
点评 本题考查了氧化还原反应中的反应先后顺序和与量有关的离子方程式的书写,难度不大,应注意的是由于还原性:SO32->I-,故氯气先和亚硫酸根反应,然后再和碘离子反应.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
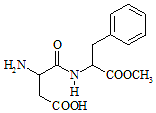 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )| A. | 分子式为C14H18N2O3,阿斯巴甜不属于蛋白质 | |
| B. | 阿斯巴甜的水解产物中只有一种氨基酸 | |
| C. | 阿斯巴甜在一定条件下不能与酸反应、只能与碱反应 | |
| D. | 阿斯巴甜分子中有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶不可以用来溶解固体,但可以用来稀释浓的溶液 | |
| B. | 粗盐提纯时过滤所用普通漏斗与萃取所用分液漏斗结构是一样的 | |
| C. | 用50mL量筒可准确配制50mL0.10mol/L的碳酸钠溶液 | |
| D. | 实验室制蒸馏水时冷凝管要“下进水、上出水”并保还水的持续流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
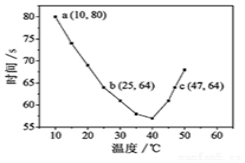 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 不能比较图中b、c两点对应的NaHSO3反应速率的大小 | |
| C. | 图中b点对应的NaHSO3反应速率为3.125×10-4mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该试验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g≤m≤128g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$的比值为( )| A. | V2-V1 | B. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | C. | $\frac{{V}_{1}}{{V}_{2}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com