
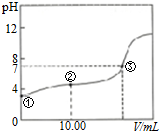
| A. | 两溶液反应的离子方程式是H++OH-+H2O | |
| B. | 图中②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| C. | 图中②点所示溶液中:c(A-)>c(H+)>c(HA)>c(OH-) | |
| D. | 图中③点所示滴入的NaOH溶液的体积V=20.00mL |
分析 根据点①是没有加入氢氧化钠之前的HA酸的溶液,根据酸的浓度和pH关系,可以得到HA是弱酸,②是将10mL0.1000mol•L-1NaOH溶液滴入20.0mL0.1000mol•L-1的一元酸HA溶液中,
此时得到的溶液是等浓度的NaA和HA的混合物,③点所示的溶液显示中性,此时得到的是NaA和剩余的少量的HA的混合物,据此回答.
解答 解:根据点①是没有加入氢氧化钠之前的HA酸的溶液,根据酸的浓度和pH关系,可以得到HA是弱酸,②是将10mL0.1000mol•L-1NaOH溶液滴入20.0mL0.1000mol•L-1的一元酸HA溶液中,此时得到的溶液是等浓度的NaA和HA的混合物,③点所示的溶液显示中性,此时得到的是NaA和剩余的少量的HA的混合物,
A、两溶液反应的离子方程式是HA+OH-=H2O+A-,故A错误;
B、图中②点所示溶液是将10mL0.1000mol•L-1NaOH溶液滴入20.0mL0.1000mol•L-1的一元酸HA溶液中,此时得到的溶液是等浓度的NaA和HA的混合物,存在物料守恒:2c(Na+)=c(HA)+c(A-),故B正确;
C、图中②点所示溶液显示酸性,此时:c(A-)>c(HA)>>c(H+)c(OH-),故C错误;
D、图中③点所示的溶液显示中性,此时得到的是NaA和剩余的少量的HA的混合物,滴入的NaOH溶液的体积V=<20.00mL,故D错误.
故选B.
点评 本题综合考查弱电解质的电离、盐的水解原理的应用等方面的知识,属于综合知识的考查,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
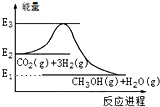
| A. | E2_E1是该反应的热效应 | |
| B. | E3_E1是该反应的热效应 | |
| C. | 该反应放热,在常温常压下就能进行 | |
| D. | 实现变废为宝,且有效控制温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
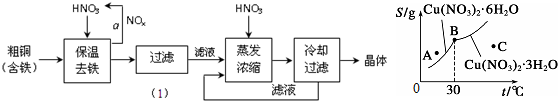
| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
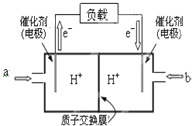 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是短周期元素中原子半径最大的 | |
| B. | X元素最高价氧化物对应的水化物,可以与其他三种元素最高价氧化物对应的水化物反应 | |
| C. | WZ4分子中每个原子最外层均达到8电子结构 | |
| D. | X元素的氧化物中只存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量与白色固体的质量均保持不变 | |
| B. | 溶液浓度和pH值均保持不变,溶液下部是1.73g氢氧化钡固体 | |
| C. | 溶液中钡离子与氢氧根离子的数目均保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 | |
| D. | 溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以电解熔融的氯化钠来制取金属钠 | |
| B. | 可以将钠加入氯化镁饱和溶液中制取镁 | |
| C. | 用电解法冶炼铝时,原料是氯化铝 | |
| D. | 在浓缩的海水加入新制氯水即可得到液溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com