
| A. | 滤液为NaCl饱和溶液 | B. | 滤液中NaCl的质量分数为36% | ||
| C. | 该温度下,NaCl的溶解度为50g | D. | 该温度下,NaCl的溶解度为36g |
分析 在100g水中加入50g NaCl固体,得到136g滤液,剩余100g+50g-136g=14gNaCl,则得到的NaCl饱和溶液中NaCl的质量为50g-14g=36g,代入ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算滤液中NaCl的质量分数.
解答 解:A.该温度下,NaCl有剩余,说明得到的NaCl溶液是饱和溶液,故A正确;
B.在100g水中加入50g NaCl固体,得到136g滤液,剩余100g+50g-136g=14gNaCl,则得到的NaCl饱和溶液中NaCl的质量为50g-14g=36g,因此滤液中NaCl的质量分数为$\frac{36g}{136g}$×100%=26.5%,故B错误;
C.该温度下,100g水中最多溶解了36gNaCl,所以NaCl的溶解度为36g,故C错误;
D.该温度下,100g水中最多溶解了36gNaCl,所以NaCl的溶解度为36g,故D正确;
故选AD.
点评 本题考查溶液中溶质的质量分数及相关计算,为高频考点,侧重于数据分析和计算能力的培养,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
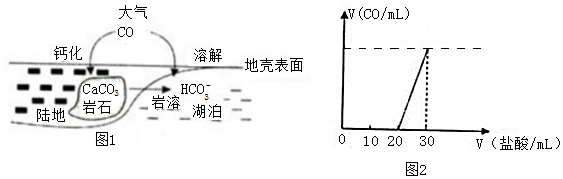
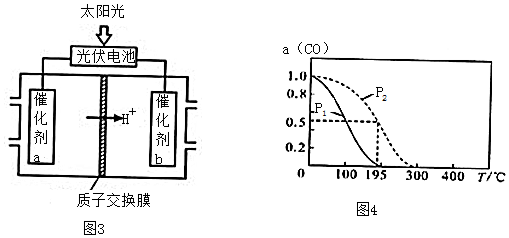
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
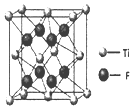 光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得.
光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得.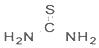 )中C原子轨道的杂化类型为.1mol硫脲中含有σ键的数目为7mol.
)中C原子轨道的杂化类型为.1mol硫脲中含有σ键的数目为7mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸与金属反应时,主要是+5价的氮得电子 | |
| B. | 浓HNO3见光易分解,所以应保存在棕色试剂瓶中 | |
| C. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| D. | 常温下,向浓⑤中投入Fe片,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
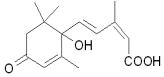 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、羰基、苯环、羧基 | |
| B. | 该有机物的分子式为C15H20O4 | |
| C. | 分子中所有的原子有可能在同一平面 | |
| D. | 该有机物属于芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③④⑥ | C. | ③④⑤⑥ | D. | ①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com