
| A. | 水电离出的c(OH):③>①>② | |
| B. | 溶液的pH:②>③>① | |
| C. | ①和②等体积混合后的溶液:c(Na+)═c(H2C03)+c(HC03)+c(C032-) | |
| D. | ①和③等体积混合后的溶液:c(Na+)>c(HC03-)>c(C032-)>c(OH-)>c(H+) |
分析 A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大、碱中氢氧根离子浓度越大其抑制水电离程度越大;
B.NaOH是强碱、碳酸钠是强碱弱酸盐、碳酸是弱酸;
C.①和②等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度而导致溶液呈碱性,根据物料守恒判断;
D.①和③等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度而导致溶液呈碱性.
解答 解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大、碱中氢氧根离子浓度越大其抑制水电离程度越大,所以水电离出c(OH):③>①>②,故A正确;
B.NaOH是强碱、碳酸钠是强碱弱酸盐、碳酸是弱酸,所以pH:②>③>①,故B正确;
C.①和②等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度而导致溶液呈碱性,根据物料守恒得c(Na+)═c(H2C03)+c(HC03)+c(C032-),故C正确;
D.①和③等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度而导致溶液呈碱性,碳酸氢根离子水解和水电离都生成氢氧根离子,只有碳酸氢根离子电离生成碳酸根离子,所以离子浓度大小顺序是c(Na+)>c(HC03-)>c(OH-)>c(C032-)>c(H+),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,注意物料守恒的灵活运用,知道碳酸氢钠溶液呈碱性原因,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
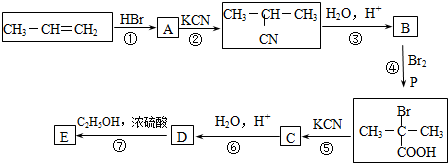

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充入氮气 | B. | 减小压强,扩大容器体积 | ||
| C. | 加入催化剂 | D. | 适当升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com