
| A.FeS不溶于水,但能溶于稀盐酸中 |
| B.CaCO3难溶于稀硫酸中,却能溶于醋酸中 |
| C.分别用等体积的蒸馏水和稀硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸造成的损失量 |
| D.Cl2与Na2S溶液反应生成单质S沉淀 |
科目:高中化学 来源:不详 题型:填空题
 2(t-BuNO) 。
2(t-BuNO) 。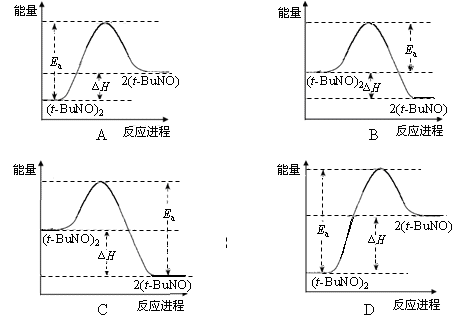
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。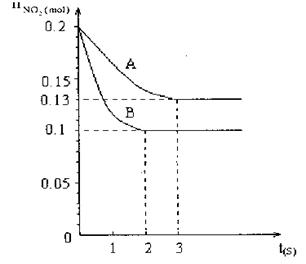
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

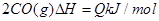 。右图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是( )
。右图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是( )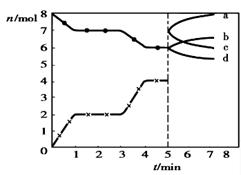
| A.0~1min,v(CO)=1mol/(L·min);1~3min时, |
B.当溶器内的压强不变时,反应一定达到平衡状态且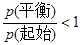 |
| C.3min时温度由T1升高到T2,则可以判断Q>0 |
| D.5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由a、b曲线表示 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):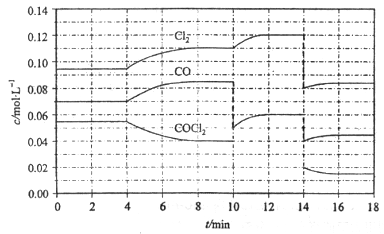
| A.COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)< v(15~16) |
| B.第10 min时,改变反应条件,反应重新达到平衡前:v(正)>v(逆) |
| C.第12 min时,反应重新达到平衡,c(COCl2)≈ 0.03 mol·L-1 |
| D.第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.夏天,打开冰镇啤酒瓶,立即冒出大量泡沫 |
| B.实验室中,配制FeSO4溶液所用的蒸馏水,可用加热的方法除去溶解氧 |
| C.侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既洒NaCl固体又通入足量NH3 |
| D.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
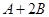
 C分别在三种不同实验条件下进行,它们的起始状态均为
C分别在三种不同实验条件下进行,它们的起始状态均为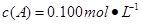 、
、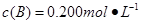 、
、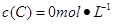 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )
。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )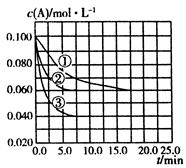
| A.反应的平衡常数:①<② |
B.反应A+2B C的 C的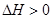 |
| C.实验②平衡时B的转化率为60% |
D.实验③平衡时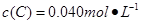 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,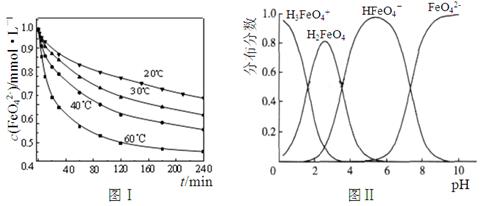
 H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。
H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制的氯水在光照条件下颜色变浅 |
| B.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com