
【题目】铬酸铅![]() 用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
(1)![]() 中Cr的化合价为________________。
中Cr的化合价为________________。
(2)铬酸铅用于水彩和油彩的筑色颜料。遇到空气中的硫化物颜色会变黑:![]() 的平衡常数
的平衡常数![]() ________________。
________________。![]()
(3)铬渣![]() 铬主要以
铬主要以![]() 形式存在,同时含有
形式存在,同时含有![]() 、
、![]() 等杂质
等杂质![]() 是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
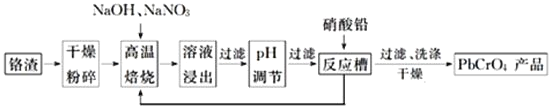
请回答下列问题:
![]() 铬渣高温焙烧前粉碎的目的是_____________________________。
铬渣高温焙烧前粉碎的目的是_____________________________。
![]() 高温焙烧得到的产物含有
高温焙烧得到的产物含有![]() 和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
![]() 高温焙烧时
高温焙烧时![]() 参加反应的化学方程式为________________________。
参加反应的化学方程式为________________________。
![]() 除去浸出液中的杂质最好加入________
除去浸出液中的杂质最好加入________![]() 填试剂名称
填试剂名称![]() 来调节pH。除去铝元素的离子方程式为___________________________________________。
来调节pH。除去铝元素的离子方程式为___________________________________________。
![]() 现通过以上流程处理
现通过以上流程处理![]() 的铬渣,得到
的铬渣,得到![]() 产品
产品![]() ,则铬渣中
,则铬渣中![]() 的质量分数是________
的质量分数是________![]() 。
。
【答案】+6 ![]() 提高铬渣焙烧的速率和转化率 6:5
提高铬渣焙烧的速率和转化率 6:5 ![]() 硝酸
硝酸 ![]()
![]()
【解析】
(1)根据在化合物中正负化合价代数和为零,计算铬元素的化合价;
(2)根据反应![]() ,可计算出平衡常数;
,可计算出平衡常数;
(3)干燥粉碎铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质),加入NaOH、NaNO3,发生反应:5Cr2O3+14NaOH+6NaNO3![]() 10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品,据此分析解答。
10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品,据此分析解答。
(1)铅元素的化合价为![]() 价,氧元素显
价,氧元素显![]() 价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+4×(-2)=0,则x=+6价;
价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+4×(-2)=0,则x=+6价;
(2)![]() 的平衡常数
的平衡常数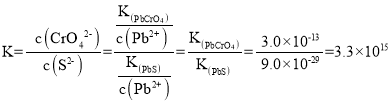 ;
;
(3)干燥粉碎铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质),加入NaOH、NaNO3,发生反应:5Cr2O3+14NaOH+6NaNO3![]() 10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品;
10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品;
①铬渣高温焙烧前粉碎的目的是提高铬渣焙烧的速率和转化率;
②高温焙烧得到的产物含有![]() 和一种无污染的气体,5Cr2O3+14NaOH+6NaNO3
和一种无污染的气体,5Cr2O3+14NaOH+6NaNO3![]() 10Na2CrO4+3N2↑+7H2O,则氧化剂和还原剂物质的量之比为6:5;
10Na2CrO4+3N2↑+7H2O,则氧化剂和还原剂物质的量之比为6:5;
③高温焙烧时![]() 与氢氧化钠反应生成硅酸钠和水,反应的化学方程式为
与氢氧化钠反应生成硅酸钠和水,反应的化学方程式为![]() ;
;
④除去浸出液中的杂质最好加入硝酸来调节pH;硝酸与偏铝酸钠反应生成氢氧化铝,除去铝元素的离子方程式为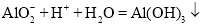 ;
;
⑤据原子守恒:
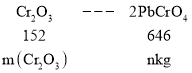
![]() ,
,
则铬渣中![]() 的质量分数是
的质量分数是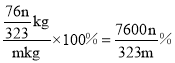 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )

A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀,然后沉淀又溶解
C.实验仪器D可以起到防止溶液倒吸的作用
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛萦洛芬钠的关键中间体,它的一种合成路线如下:
(1)A的化学名称为___________。
(2)G的分子式为___________;H中官能团的名称是___________。
(3)E的结构简式为___________,反应②的反应类型为___________。
(4)反应⑥的化学方程式为___________。
(5)写出同时满足下列条件的F的同分异构体的结构简式___________。
Ⅰ.能发生水解反应生成酸和醇
Ⅱ.能发生银镜反应
Ⅲ.核磁共振氢谱有5组峰且峰面积之比为3∶2∶2∶2∶1
(6)仿照H的合成线,设计一种由![]() 合成
合成![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
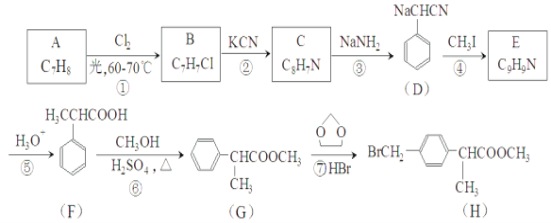
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。某课外小组模拟其原理选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明潮湿的CO2可与过氧化钠反应生成O2。可供选择的药品有:石灰石、盐酸、饱和NaHCO3溶液、NaOH溶液、Na2O2固体
(1)如何检查该套装置的气密性?____________ 。
(2)A是制取CO2的装置,写出A中发生反应的化学方程式______________。
(3)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | ________ | 吸收挥发出来的HCl |
C | ________ | |
D | ________ | ________ |
(4)写出过氧化钠与二氧化碳反应的化学方程式:_______________。
(5)试管F中收集满气体后,要用拇指堵住试管口,移出水面,接下来的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、用如图仪器组装成一套简易量热计测定室温下中和反应的反应热。

(1)碎泡沫塑料的作用是__________;图中仪器a的名称是____________;
(2)中和反应的实质是_______________(用离子方程式表示)。
Ⅱ、.某研究性学习小组的同学对Zn、Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用下图I装置进行探究,乙同学经过查阅资料后设计了图II装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
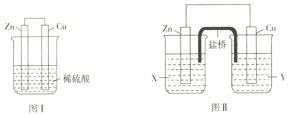
(3)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为_____能;铜电极上有气泡产生,说明反应中有一部分化学能转化为____能。
(4)图II中的X、Y是ZnSO4溶液及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X是_________,正极上的电极反应式为__________。
(5)当图I装置的溶液质量增加63g时,生成的氢气共有______L(标准状况;当图II中锌电极质量减少65g时,电路中转移的电子数为______NA。
Ⅲ、在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图:
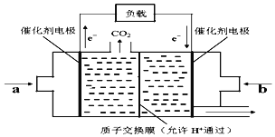
(6)若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_____________________
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g) 的ΔH=________kJ·mol-1
SO3(g)+NO(g) 的ΔH=________kJ·mol-1
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________ (保留两位小数)
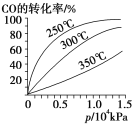
(4)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________________
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲 乙
乙 丙
丙 丁
丁![]()
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
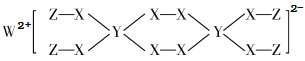
A.工业上通过电解熔融的WX来制得W
B.W、X、Y、Z的原子半径顺序为:W > X > Y > Z
C.W、X、Z元素各自形成的简单离子均能破坏水的电离平衡
D.该漂白剂中各元素均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com