
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.015 | 0.012 | 0.010 | 0.010 | 0.010 |
| A. | 在0~2s内,v(O2)=0.002mol•L-1•s-1 | |
| B. | 5s后向容器中通入0.02mol NO2,再次平衡后,0.020mol<n(NO2)<0.040 mol | |
| C. | 在该温度时,向容器中加入O2,平衡将正向移动,平衡常数增大 | |
| D. | 5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,平衡向正向移动 |
分析 A.根据化学反应速率v(NO)=$\frac{△c}{△t}$=$\frac{△n}{V•△t}$,根据化学反应速率之比等于系数值比计算v(O2);
B.向容器中通入0.02mol NO2,相当于增大了体系的压强,会引起化学平衡的移动;
C.增加反应物的浓度,化学平衡正向移动,但是化学平衡常数数温度的函数;
D.化学平衡体系中,增大压强,2NO(g)+O2(g)?2NO2(g)平衡会发生移动.
解答 解:A.化学反应速率v(NO)=$\frac{△c}{△t}$=$\frac{△n}{V•△t}$=$\frac{0.012mol-0.020mol}{2L×2s}$=0.002mol•L-1•s-1,根据化学反应速率之比等于系数值比,所以v(O2)=0.001mol•L-1•s-1,故A错误;
B.向容器中通入0.02mol NO2,相当于增大了体系的压强,会引起化学平衡向正向移动,再次平衡后,0.020mol<n(NO2)<0.040mol,故B正确;
C.向容器中加入O2,平衡将正向移动,但是化学平衡常数数温度的函数,温度没变,所以平衡常数不变,故C错误;
D.5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,相当于在化学平衡体系中增大压强,2NO(g)+O2(g)?2NO2(g)平衡会向着正方向发生移动,故D正确;
故选AC.
点评 本题考查了化学反应速率和化学平衡的移动的综合应用,侧重于数据分析能力及应用化学理论去解决问题的能力,难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 它的分子式是C8H8 | B. | 与苯乙烯 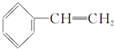 互为同分异构体 互为同分异构体 | ||
| C. | 它不能发生加成反应 | D. | 它的二氯取代物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量NaHCO3和Na2CO3的分别与足量盐酸完全反应,Na2CO3产生的CO2少 | |
| B. | 84g NaHCO3、106g Na2CO3分别与同浓度足量盐酸完全反应,Na2CO3消耗盐酸的是NaHCO3两倍 | |
| C. | 将澄清石灰水、CaCl2溶液分别倒入两种盐溶液中,都只有Na2CO3产生沉淀 | |
| D. | 通常情况下,Na2CO3的溶解度大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、Cl-、NO${\;}_{3}^{-}$ | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Ag+、Cl-、OH- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com