
分析 (1)根据盖斯定律:Ⅱ=Ⅰ-Ⅲ得反应②的△H2;
(2)化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,反应能自发进行,据此解答;
(3)①依据平衡标志是正逆反应速率相同,个组分含量保持不变;
②依据反应速率V=$\frac{△c}{△t}$;
③依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
④据影响化学反应速率和平衡移动的规律分析;
⑤恒容容器中再加入4molSO2和2molO2,相当于增大压强,平衡正向进行;
(4)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,先生成沉淀(填化学式),当两种沉淀共存时,依据溶度积常数计算.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1,反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2,反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1,根据盖斯定律:Ⅱ=Ⅰ-Ⅲ得反应②的△H2=+41.19 kJ•mol-1;
故答案为:+41.19 kJ•mol-1;
(2)△G=△H-T•△S<0时,反应能够自发进行,该反应的△S<0,反应Ⅲ能够自发进行的原因是△H<0,
故答案为:△H<0;
(3)①2SO2(g)+O2(g)?2SO3(g),反应是气体体积减少的放热反应;
A.反应速率之比等于化学方程式计量数之比,为正反应速率之比,2v(O2)正=v(SO3)逆,能说明反应达到平衡状态,v(O2)正=2v(SO3)逆不能说明故A错误
B.反应是气体物质的量减少的反应,反应前后气体质量不变,气体的平均相对分子质量不变,说明反应达到平衡状态,故B正确;
C.反应前后气体质量和体积不变,气体的密度始终不变,不能说明反应达到平衡状态,故C错误;
D.反应是气体物质的量减少的反应,气体的分子总数不变说明反应达到平衡状态,故D正确;
故答案为:BD;
②一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L,用SO2的浓度变化表示的反应速率=$\frac{0.6mol/L}{2min}$=0.3mol/L•min;
故答案为:0.3mol/(L?min);
③一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L,依据化学平衡三段式列式计算:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 2 1 0
变化量(mol/L) 0.6 0.3 0.6
平衡量(mol/L) 1.4 0.7 0.6
平衡常数K=$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$=$\frac{0.{6}^{2}}{1.{4}^{2}×0.7}$=0.26L/mol;
故答案为:0.26L/mol;
④A.升高温度平衡逆向移动,故A错误;
B.缩小容器体积反应速率加快,平衡正向移动,故B正确;
C.分离出SO3 反应速率减慢,故C错误;
D.改变催化剂不影响平衡移动,故D错误;
故答案为B;
⑤恒容容器中再加入4molSO2和2molO2,相当于增大压强,平衡正向进行,再次达到平衡时SO2的转化率增大;
故答案为:向右;增大;
(4)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,碘化银溶度积常数小于溴化银,先生成沉淀AgI,AgBr+I-=AgI+Br-,当两种沉淀共存时,银离子浓度相同,c(Br-)与c(I-)的比值=$\frac{{K}_{sp}(AgBr)}{{K}_{sp}(AgI)}$=$\frac{5.4×1{0}^{-13}}{8.5×1{0}^{-17}}$=6.35×103;
故答案为:6.35×103.
点评 本题考查了化学平衡、化学反应速率的影响因素分析判断,化学平衡常数的计算,沉淀溶解平衡的分析应用,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3常用作制冷剂 | |
| B. | 小苏打用制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 二氧化硅常用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )| A. | 该原电池正极的电极方程式为:O2+4e-+4H+═2H2O | |
| B. | 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O | |
| C. | 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g | |
| D. | 该伏打电堆工作时,在银板附近会有Cl2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 若Ksp(AgCl)>Ksp(Ag2CrO4),则AgCl 的溶解度大于Ag2CrO4的溶解度 | |
| D. | 向醋酸溶液中加少量水稀释后,溶液中 c(CH3COOH)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
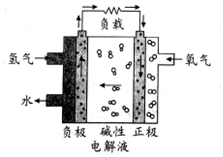
| A. | 通入氢气的电极发生氧化反应 | |
| B. | 正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 碱性电解液中阳离子向通入氢气的方向移动 | |
| D. | 放电过程中碱性电解液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| C. | 1.5mol的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 1L0.01 mol•L-1CKA1(SO4)2溶液中含有的阳离子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com