
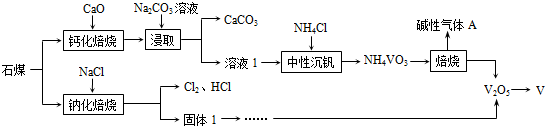
分析 石煤是低品位的含钒矿石,其中钒元素主要以VO2、V2O3、V2O5形式存在,采用钙化焙烧提钒和钠化焙烧提钒的部分工艺为,石煤加入氧化钙钙化焙烧,加入碳酸钠溶液浸取得到碳酸钙和溶液1,溶液1处理后加入氯化铵中性沉钒,得到NH4VO3,焙烧得到V2O5和减小气体氨气,电解五氧化二钒得到金属钒,加入氯化钠进行石煤钠化焙烧得到氯气、氯化氢和固体1为NaVO3,加入氯化铵沉钒焙烧得到V2O5,电解得到金属钒,
(1)“钙化焙烧提钒”工艺中需要焙烧炉和分离装置离心机;
(2)①由V2O3得到Ca(VO3)2的反应是三氧化二钒和氧气反应生成五氧化二钒,五氧化二钒和氧化钙反应生成Ca(VO3)2;氧化钙可以利用碳酸钙高温分解生成;
②“浸取”操作中反应是利用加入的碳酸钠和Ca(VO3)2反应生成碳酸钙沉淀和溶液1,Ca(VO3)2在水中的溶解度很小书写离子方程式写化学式;
③NH4VO3焙烧时产生的碱性气体A为氨气,可以利用氨气和氯化氢气体反应生成氯化铵可循环利用;
(3)“钠化焙烧提钒”工艺中,固体1和溶液1含钒物质的主要成分相同,固体1的含钒物质为NaVO3,反应的气体产物Cl2、HCl会污染环境,可以用氢氧化钠溶液吸收;
(4)以V2O5为原料,通过铝热反应冶炼钒是利用铝还原V2O5生成钒单质和氧化铝,依据钒元素的利用率和元素计算.
解答 解:石煤是低品位的含钒矿石,其中钒元素主要以VO2、V2O3、V2O5形式存在,采用钙化焙烧提钒和钠化焙烧提钒的部分工艺为,石煤加入氧化钙钙化焙烧,加入碳酸钠溶液浸取得到碳酸钙和溶液1,溶液1处理后加入氯化铵中性沉钒,得到NH4VO3,焙烧得到V2O5和减小气体氨气,电解五氧化二钒得到金属钒,加入氯化钠进行石煤钠化焙烧得到氯气、氯化氢和固体1为NaVO3,加入氯化铵沉钒焙烧得到V2O5,电解得到金属钒,
(1)“钙化焙烧提钒”工艺中需要焙烧炉和分离装置离心机,不需要离子交换和蒸馏,故答案为:AB;
(2)①由V2O3得到Ca(VO3)2的反应是三氧化二钒和氧气反应生成五氧化二钒,五氧化二钒和氧化钙反应生成Ca(VO3)2,反应的化学方程式为:V2O3+O2$\frac{\underline{\;高温\;}}{\;}$V2O5,V2O5+CaO$\frac{\underline{\;高温\;}}{\;}$Ca(VO3)2,氧化钙可以利用碳酸钙高温分解生成,在此生产工艺中,CaO可用CaCO3代替,
故答案为:V2O3+O2$\frac{\underline{\;高温\;}}{\;}$V2O5,V2O5+CaO$\frac{\underline{\;高温\;}}{\;}$Ca(VO3)2,CaCO3;
②“浸取”操作中反应是利用加入的碳酸钠和Ca(VO3)2反应生成碳酸钙沉淀和溶液1,Ca(VO3)2在水中的溶解度很小书写离子方程式写化学式,离子方程式为:Ca(VO3)2+CO32-=CaCO3↓+2VO3-,
故答案为:Ca(VO3)2+CO32-=CaCO3↓+2VO3-;
③NH4VO3焙烧时产生的碱性气体A为氨气,可以利用氨气和氯化氢气体反应生成氯化铵可循环利用,具体措施是:用盐酸吸收碱性气体生成氯化铵用于中性沉钒,
故答案为:用盐酸吸收碱性气体生成氯化铵用于中性沉钒;
(3)固体1和溶液1含钒物质的主要成分相同,固体1的含钒物质为NaVO3,反应的气体产物Cl2、HCl会污染环境,可以用氢氧化钠溶液吸收,
故答案为:NaVO3,NaOH;
(4)以V2O5为原料,通过铝热反应冶炼钒是利用铝还原V2O5生成钒单质和氧化铝,反应的化学方程式为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,依据钒元素的利用率和元素计算,某石煤中矾元素的含量为1.2%,使用“钠化焙烧提钒”工艺,矾的总回收率为77%,则10t石煤理论上最多可以生产钒的质量=10t×1.2%×77%=0.0924t≈0.092t,
故答案为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,0.092.
点评 本题考查了物质分离提纯的生成流程分析,主要是信息利用和物质性质的理解应用,注意反应产物的判断和化学方程式书写,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
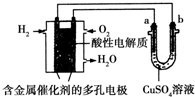
| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度减小 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+H2O═2OH- | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
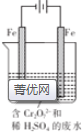 铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.
铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.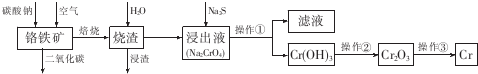
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
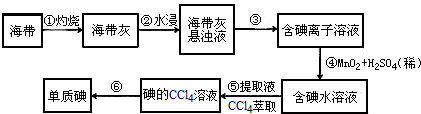
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com