
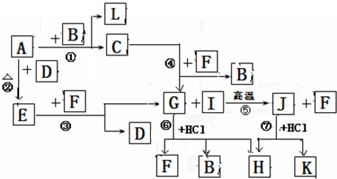
分析 根据题意,A、D、L为单质,其他为化合物,B常温下为液态化合物,F是一种直线型的非极性气体分子,所以是水B为水,G和I的反应⑤是一种重要化工生产中的主要反应之一,G和盐酸反应的生成物为三种,可知F为CO2,G为Na2CO3,I 为SiO2,J为Na2SiO3,反应⑤为工业制玻璃的反应,J和G与盐酸反应都生成H,所以H为NaCl,则K为H2SiO3,依据转化关系,C为NaOH,A、D、L为单质,A和B反应生成氢氧化钠和L,则A为Na,L为H2,A和D反应生成E,E和F生成碳酸钠和D,推断为E为Na2O2,D为O2,依据判断出的物质分析回答问题.
解答 解:(1)根据推断可知①是置换反应,②是化合反应,③是氧化还原反应,④是复分解反应,⑤是复分解反应,⑥是复分解反应,⑦是复分解反应,所以发生自身氧化还原反应的是过氧化钠和二氧化碳的反应为③,故答案为:③;
(2)在G为Na2CO3、J为Na2SiO3、H为NaCl,所以三种物质中含有相同的元素是Na,故答案为:Na;
(3)J(Na2SiO3)的水溶液和F(CO2)反应生成碳酸钠和硅酸,反应的理由是较强酸制较弱的酸,故答案为:能; 较强酸制较弱的酸;
(4)电解溶液H(NaCl)的阴极电极反应方程式是:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(5)反应⑤是二氧化硅和碳酸钠在高温条件下反应生成硅酸钠和二氧化碳,反应的化学方程式是:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;故答案为:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
(6)J为Na2SiO3,J常见的用途为木材防火剂,黏合剂,
故答案为:木材防火剂,黏合剂.
点评 本题考查了无机物质的相互转化关系,物质性质的应用,主要考查转化关系的综合推断能力,反应类型的判断,碳及其化合物、硅及其化合物、钠及其化合物性质的应用,电解反应离子方程式的书写,题目较难,需要熟练掌握物质性质,较强的综合推断能力.


科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
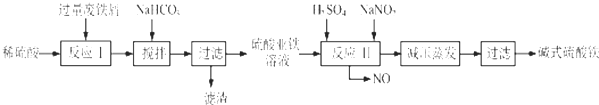
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
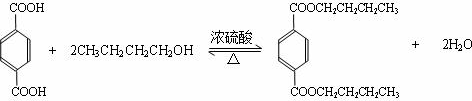 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
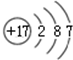 ②
②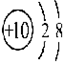 ③
③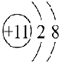 ④
④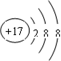
| A. | ①②两种粒子所属的元素在元素周期表的同一横行 | |
| B. | ②③④对应的元素化学性质相似 | |
| C. | ①③对应的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 将一定量的Na2O2和NaHCO3的混合物放在一密闭容器中充分加热后,所得固体中一定含有Na2CO3 | |
| C. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| D. | 将足量的稀盐酸加到Mg、AlCl3、NaAlO2组成的混合物中,只能发生一种反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中易变质,所以应密封保存 | |
| B. | 工业上可用铁质容器存放浓硫酸 | |
| C. | 液氯可储存在钢瓶中,便于运输和使用 | |
| D. | 硅酸钠的水溶液俗称“水玻璃”,可保存在带玻璃塞的细口瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com