
下列现象或事实不能用同一原理解释的是()
A. 浓硝酸和氯水用棕色试剂瓶保存
B. 硫化钠和亚硫酸钠固体长期暴露在空气中变质
C. 常温下铁和铂都不溶于浓硝酸
D. SO2和Na2SO3溶液都能使氯水褪色
考点: 硝酸的化学性质;氯气的化学性质;二氧化硫的化学性质;含硫物质的性质及综合应用.
专题: 元素及其化合物.
分析: A.浓硝酸见光易分解;氯水见光会分解;
B.硫化钠具有还原性,易被空气中的氧气氧化而变质;亚硫酸钠具有还原性,易被空气中的氧气氧化而变质;
C.常温下铁遇浓硝酸,发生钝化;铂的活泼性较弱,与浓硝酸不反应;
D.SO2具有还原性,能与氯水发生氧化还原反应使氯水褪色;Na2SO3具有还原性,能与氯水发生氧化还原反应使氯水褪色.
解答: 解:A.浓硝酸见光易分解,须存放在棕色瓶中;氯水见光会分解,应盛放在棕色瓶中,能用同一原理解释,故A不选;
B.硫化钠具有还原性,易被空气中的氧气氧化而变质;亚硫酸钠具有还原性,易被空气中的氧气氧化而变质,能用同一原理解释,故B不选;
C.常温下铁遇浓硝酸,发生钝化;铂的活泼性较弱,与浓硝酸不反应,不能用同一原理解释,故C可选;
D.SO2具有还原性,能与氯水发生氧化还原反应使氯水褪色;Na2SO3具有还原性,能与氯水发生氧化还原反应使氯水褪色;能用同一原理解释,故D不选;
故选C.
点评: 本题考查物质的保存、金属的钝化、硫的化合物的性质等,难度中等.要注意基础知识的积累.


科目:高中化学 来源: 题型:
关于热化学方程式:2H2(g)+02(g)=2H20(1),△H=﹣571.6kJ•mol﹣1,下列有关叙述不正确的是()
A. 2mol H2完全燃烧生成液态水时放出571.6 kJ的热
B. 1mol H2完全燃烧生成液态水时放出285.8kJ的热
C. 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D. 上述热化学方程式可表示为H2(g)+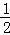 O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 要实现Fe2+→Fe3+的转化必须加入氧化剂
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能够大量共存的是()
A. pH=0的溶液中:Fe3+、Mg2+、Cl﹣、SO42﹣
B. 能与铝反应生成氢气的溶液中:K+、HC03﹣、Cl﹣、S2﹣
C. 使pH试纸显蓝色的溶液中:Cu2+、Fe3+、N03﹣、SO42﹣
D. 在A1C13溶液中:Na+、﹣、SO42﹣、N03﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如图:

(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 ,①和⑥中都用到的仪器为 ;
(2)试剂x的化学式为H2O2;x与溶液B反应的离子方程式为 ;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN﹣ 被过量的氧化剂氧化所致,现给出以下试剂:1.0mol•L﹣1硫酸、1.0mol•L﹣1 NaOH溶液、0.1mol•L﹣1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合理实验验证乙同学的猜测是否合理.简要说明实验步骤和现象 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与100ml 1mol•L﹣1AlCl3溶液中Cl﹣相等的是()
A. 150ml 1 mol•L﹣1氯化钠溶液
B. 75ml 2 mol•L﹣1氯化镁溶液
C. 50ml 3mol•L﹣1氯化钾溶液
D. 200ml 1.5 mol•L﹣1氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是用于气体制备、干燥(或除杂质)、性质验证、尾气处理的部分仪 器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用).请根据下列要求回答问题.
器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用).请根据下列要求回答问题.
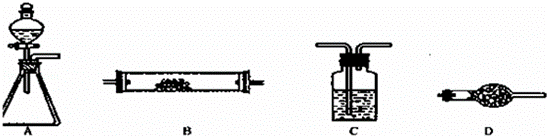
(1)若用A﹣C﹣D﹣B组合进行氢气还原氧化铜实验.分液漏斗中的试剂是盐酸,C中试剂是水,其作用是 ;A中反应开始一段时间后,再加热B.加热B之前的实验操作是 .
(2)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A﹣C﹣B﹣D连接成实验装置体系.A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是 (填名称);C中试剂是浓硫酸(填名称).已知高锰酸钾反应生成+2价的锰离子,写出此法制备氯气的离子方程式 .
(3)为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是(填字母) ;装置B中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氢氧化铁胶体和氯化镁溶液的说法中正确的是()
A. 可用丁达尔现象区分氢氧化铁胶体和氯化镁溶液两种分散系
B. 两者的分散质微粒均能透过半透膜和滤纸
C. 将氢氧化铁固体和氯化镁固体分别溶于水中即可得到氢氧化铁胶体和氯化镁溶液
D. 两种分散系中的分散质微粒直径均介于1~100nm之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com