
 C(g)在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”“减慢”或“不变”):?a.升温 ;?b.增大压强 ;c.增大容器容积 ;?d.加入A ;?e.加入B ;?f.加正催化剂 .
C(g)在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”“减慢”或“不变”):?a.升温 ;?b.增大压强 ;c.增大容器容积 ;?d.加入A ;?e.加入B ;?f.加正催化剂 .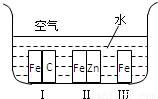
 ,
,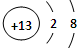 ;
; C(g)在其他条件不变时,改变其中一个条件,
C(g)在其他条件不变时,改变其中一个条件,

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
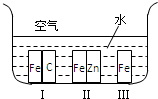 (1)在第3周期中,置换酸中氢的能力最强的元素的元素符号为
(1)在第3周期中,置换酸中氢的能力最强的元素的元素符号为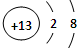
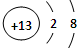
 C(g)在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”“减慢”或“不变”):?a.升温
C(g)在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”“减慢”或“不变”):?a.升温查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省济南市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第3周期中,第一电离能大于B的元素有??? 种;
A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为???????

(2)B的氢化物(H2B)分子的空间构型为 ????????? ;在乙醇中的溶解度:s(H2C)>s(H2B),其原因是???????? 。
(3)B与C可形成BC42-
①BC42-中,B原子轨道的杂化类型是??? 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC42-互为等电子体的分子的化学式为? ??? ? (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有 键的物质的量为??? mol。
键的物质的量为??? mol。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com