
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。

(1)仪器P的名称是______。
(2)写出装置A中烧瓶内发生反应的离子方程式:_________。
(3)B装置中所盛试剂是_____,G瓶的作用是_______。
(4)F为ClO2收集装置,应选用的装置是____(填序号),其中与E装置导管相连的导管口是_____(填接口字母)。

(5)若用100 mL 2 mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是_____(填序号)。
A.>0.1mol B.0.1 mol C.<0.1 mol D.无法判断
【答案】分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和食盐水 防倒吸(安全瓶) ② d C
Mn2++Cl2↑+2H2O 饱和食盐水 防倒吸(安全瓶) ② d C
【解析】
由题目中所给信息和实验装置图可知:本实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl![]() MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集;并注意气体的性质和装置来分析防止倒吸的装置,利用稀盐酸与二氧化锰不反应来分析浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量等于氯气的物质的量,以此解答该题。
MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集;并注意气体的性质和装置来分析防止倒吸的装置,利用稀盐酸与二氧化锰不反应来分析浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量等于氯气的物质的量,以此解答该题。
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗,故答案为:分液漏斗。
(2)浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl(浓)![]() MnCl2++Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-
MnCl2++Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(3)生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质;ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸(或安全瓶),故答案为:饱和食盐水;防倒吸(安全瓶)。
(4)ClO2是一种易溶于水的气体,且密度比空气大,应用向上排空气法收集,且进行尾气处理,故用双孔橡皮塞,故答案为:②;d。
(5)浓盐酸在加热条件下与二氧化锰发生氧化还原反应,但随着反应的进行,盐酸浓度变稀时,不与二氧化锰反应,根据MnO2+4HCl(浓)![]() MnCl2++Cl2↑+2H2O可以知道,若用100mL2mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量<0.1mol,故答案为C。
MnCl2++Cl2↑+2H2O可以知道,若用100mL2mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量<0.1mol,故答案为C。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法不正确的是
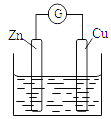
A. 锌电极上的反应为Zn-2e-=Zn2+
B. 电子从锌电极经过硫酸铜溶液流向铜电极
C. 溶液中的SO42-向锌电极移动
D. 铜电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)已知:Fe3O4(s) + CO(g)=3FeO(s) + CO2(g)ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g)ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2 CO(g)ΔH3= +172.4 kJ·mol-1
写出以铁氧化物为催化剂裂解水制氢气总反应的热化学方程式___________。
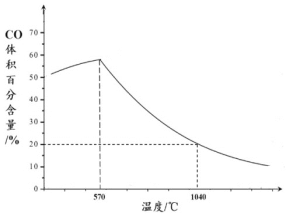
(2)下图表示其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
①当温度低于570℃时,温度降低,CO的转化率__________(填“增大”、“减小”或“不变”),理由是_______________。
②当温度高于570℃时,随温度升高,反应Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
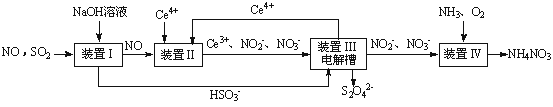
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2:1时的离子方程式:________________________。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数,否则不给分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据金属活动性顺序分析,下列描述或判断错误的是
A.铜活动性不强,故铜不能与硝酸银溶液反应得到金属银
B.在氧气中灼烧时,铁丝比铜丝反应剧烈
C.与同种盐酸反应时,锌片比铁片反应剧烈
D.常温下,在空气中金属镁比铁容易氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1molO2的质量为32g·mol-1
B. 1mol物质的质量等于该物质的相对分子质量或相对原子质量
C. SO42-的摩尔质量为96 g·mol-1
D. CO2的摩尔质量为44g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属钛的推断不正确的是( )
A.钛的原子序数为22
B.钛位于元素周期表第四周期
C.钛原子核外电子排布式为1s22s22p63s23p63d4
D.钛属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为,苯分子的结构中碳碳间以单、双键交替排列结合成环状。为了验证凯库勒的观点,某学生设计了以下实验方案:

①按如图所示的装置连接好仪器;
②检测装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;
④待烧瓶C中气体收集满后,将导管b的下端插入烧杯里的水中,挤压预先盛有水的胶头滴管,观察实验现象。
(1)A中所发生反应的反应类型为__________________,能证明凯库勒观点错误的实验现象是_______________________________________。
(2)装置B的作用是______________________________________________。
(3)烧瓶C的容积为500mL,收集气体时,由于空气未排尽,最终水未能充满烧瓶,假设烧瓶中混合气体对氢气的相对密度为37.9,则实验结束后,进入烧杯中的水的体积___ml(空气的相对分子质量以29计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能使酸性高锰酸钾溶液褪色又能与溴水反应褪色的是( )
①丙烷;②苯;③聚乙烯;④苯乙烯;⑤丙烯;⑥环己烷;⑦邻二甲苯;⑧环己烯。
A.③④⑤⑧B.④⑤⑦⑧C.④⑤⑧D.③④⑤⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com