过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa
2CO
3?bH
2O
2.现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO
2粉末,充分反应后生成672mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A.现向三份体积为10mL、浓度为c mol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
(1)稀硫酸的物质的量浓度c=
mol/L.
(2)计算确定过碳酸钠的化学式.
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品.现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na
2S
2O
3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品.(已知:2Na
2S
2O
3+I
2═Na
2S
4O
6+2NaI)



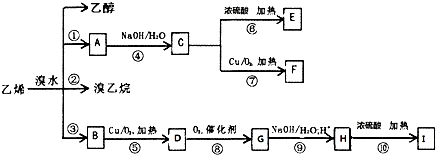
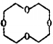 I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
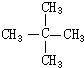 b.CH3CH2CH2CH2CH3 c.CH3CH=CHCH3 d.CH3CH=CH2
b.CH3CH2CH2CH2CH3 c.CH3CH=CHCH3 d.CH3CH=CH2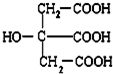



 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )