
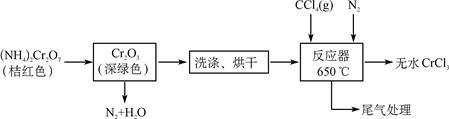
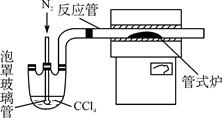


科目:高中化学 来源:不详 题型:单选题
| A.漂白粉:2Cl2—Ca(ClO)2 | B.H2SO4:FeS2—2H2SO4 |
| C.氨:C—H2—2/3 NH3 | D.HNO3: NH3—HNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯碱工业中若阳极产生0.1mol氯气则通过溶液的电子的物质的量为0.2mol |
| B.1L 1mol/LNa2CO3溶液中阴离子和阳离子的总数为3×6.02×1023 |
C.当碳酸溶液的PH增大1时,溶液中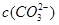 可能增大也可能减小 可能增大也可能减小 |
| D.乙烯和苯分子中都存在碳碳双键,都能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH3OH(g) △H = —90.7kJ·mol—1
CH3OH(g) △H = —90.7kJ·mol—1 CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1
CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1 CO2(g)+H2(g)△H = —41.2kJ·mol—1
CO2(g)+H2(g)△H = —41.2kJ·mol—1 CH3OCH3(g)+CO2(g),则该反应的△H =
CH3OCH3(g)+CO2(g),则该反应的△H =  CH3OCH3(g)+3H2O(g)△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
CH3OCH3(g)+3H2O(g)△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚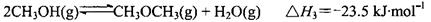
 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。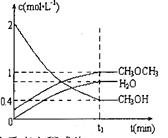
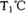 时该反应的平衡常数为
时该反应的平衡常数为  、
、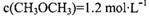 此时正、逆反应速率的大小:
此时正、逆反应速率的大小: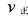 _______
_______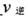 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。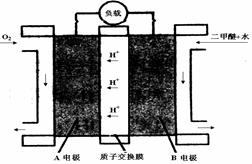
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用太阳能等代替化石燃料,符合低碳节能减排的要求 |
| B.油脂在碱性条件下水解可制得肥皂 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.二氧化硫的大量排放是造成光化学烟雾的主要原因 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨工业用铁触媒作催化剂,可加快正、逆反应速率 |
| B.合成氨工业对原料气进行压缩,可增大原料气的转化率 |
| C.硫酸工业中,采取通入适当过量的空气,以提高SO2的转化率 |
| D.硫酸工业中,在催化反应室安装热交换装置可利用SO3转化为H2SO4时放出的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com