
【题目】如图所示,一密闭气缸被一不漏气但可滑动的活塞隔开分成两部分。反应前,左边充有N2,右边充有H2、O2的混合气体;20℃时,将右边混合气体点燃,反应后冷却到20℃,若活塞最终静置于气缸的中央(液体体积忽略不计)。则反应前容器中N2和O2的物质的量之比可能为

A. 3:5 B. 5:4 C. 2:7 D. 2:5
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g)![]() Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A. 向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B. 用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C. 向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D. 当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油裂化的目的是为了得到气态短链烃
B. 苯与溴的四氯化碳溶液充分混合仅发生萃取
C. 相同温度下,酯在酸性环境下的水解程度小于碱性环境
D. 煤的干馏是指煤在空气中加强热发生复杂的物理、化学变化的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2 =5.6×10-6 |
回答下列问题:
(1)浓度均为0.1 molL-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是_____________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为________________。Na2HPO3是_____________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1 molL-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是______(填字母)。
A.c(H+) B.  C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2 mol L-1的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_______________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确且能合理解释亊实的是
A. SO2随雨水降落.形成酸雨:SO2+ H2O = 2H+ + SO32-
B. 向Mg(HCO3)2溶液中加人过量NaOH溶液,产生白色沉淀:Mg2+ +2HCO3- +2OH -= MgCO3↓+2H2O
C. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置—段时间后,溶液变蓝: 4H++4I-+O2=2I2+2H2O
D. Cl2通入FeCl2 溶液中生成 FeCl3:Fe2++Cl2=2Cl-+Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与 Y同族,Z 与X 形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存利用,常利用NaOH溶液来“捕捉”CO2,过程如图所示(部分条件及物质未标出)。
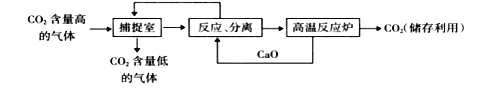
下列说法错误的是
A. 能耗大是该方法的一大缺点
B. “反应、分离”环节中,分离的基本操作是蒸发、结晶
C. 整个过程中,有2种物质可以循环利用
D. “反应、分离”环节中,有复分解反应发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com