
四川有丰富的天然气资源,以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

请填写下列空白:
(1)已知0.5 mol甲烷与0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧
化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是:
________________________________________________________________。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气
体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气
和氢气。请运用化学反应速率和化学平衡的观点说明采取该措施的理由:
________________________________________________________________。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成
________L氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为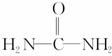 ,请写出两种含有碳氧双键的尿素
,请写出两种含有碳氧双键的尿素
的同分异构体的结构简式:
①_______________________________________________________________;
②_______________________________________________________________。
解析 (1)0.5 mol CH4完全反应吸收a kJ热量,则1 mol CH4完全反应吸收2a kJ热量,热化学方程式为CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+2a kJ·mol-1。
(2)采用循环操作有利于增大反应物浓度,增大反应速率,提高转化率;减少NH3浓度有利于平衡正向移动。
(3)由反应化学方程式可求转化关系1CH4~3H2~2NH3,V(NH3)=5.60×107 L×75%×2=8.4×107 L。
(4)可先写出 结构,再与其余基团连接。可写出异构体
结构,再与其余基团连接。可写出异构体
 和NH4N=C=O的结构简式。
和NH4N=C=O的结构简式。
答案 (1)CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+2a kJ·mol-1
CO(g)+3H2(g) ΔH=+2a kJ·mol-1
(2)增大氮气和氢气的浓度有利于增大反应速率;减小氨气的浓度、增大氮气和氢气的浓度均有利于平衡向正反应方向移动
(3)8.4×107
(4)①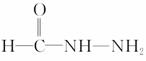 ②NH4N=C=O
②NH4N=C=O


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
下表是关于有机物A、B的信息:
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为 ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为
|
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为________;写出在一定条件下,A发生聚合反应生成高分子化合物的化学方程式____________________。
(2)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现属于同类物质的同分异构体(分别为A、B的同系物)时,碳原子数的最小值n=________,x=________。
(3)B具有的性质是_________________________________________________。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )。
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+ )=c(Cl-)>c(CH3COO- )>c(OH- )
B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH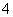 )>c(Cl-)>c(OH- )
)>c(Cl-)>c(OH- )
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合: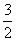 c(Na+)=c(CO
c(Na+)=c(CO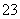 )+c(HCO
)+c(HCO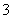 )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸): 2c(C2O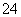 )+c(HC2O
)+c(HC2O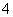 )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
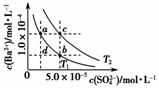
(1)T1________T2(填“>”、“<”或“=”),T2时Ksp(BaSO4)=________。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是___________________________________________________________
__________________________________________________________________
(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol
·L-1 Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________ mol·L-1。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业中,原料气(N2、H2、混有少量CO、NH3)在进入合成塔之前,常用醋酸二氨合铜(Ⅰ)溶液来吸收CO,其反应为CH3COO[Cu(NH3)2]+CO+NH3
CH3COO[Cu(NH3)3]·CO(正反应为放热反应)。
(1)必须除去CO的原因是_______________________________________。
(2)醋酸二氨合铜(Ⅰ)溶液吸收原料气中CO的适宜条件是
____________________________________________________。
(3)吸收CO后的醋酸铜(Ⅰ)氨溶液经适当处理又可再生,恢复其吸收CO的能力而循环使用,其再生的条件是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是
A. 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3===2Cu2++CO2↑+3H2O
B. 将Na2O2固体投入H218O中:2H218O+2Na2O2===4OH-+4Na++18O2↑
C. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO 完全沉淀:
完全沉淀:
2Ba2++NH +Al3++2SO
+Al3++2SO +4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓
+4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓
D. 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO +20H+===4Fe3++3O2↑+10H2O
+20H+===4Fe3++3O2↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
若按图甲装置进行实验,图乙中x、y分别表示流入电极的电子、某产物的物质的量。若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液,电解过程中溶液的pH随时间t变化的示意图如丙所示。则下列叙述中正确的是( )
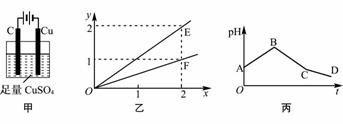
A. E表示反应生成Cu的物质的量 B. F表示反应生成H2SO4的物质的量
C. BC段阳极产物是Cl2 D. CD段电解的物质是水
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃, 10min后升高并维持容器的温度为T2℃。下列说法正确的是( )
A.前5min反应的平均速率v(N2O4)=0.18mol·L-1·s-1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2. 0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com