
 (1)研究硫及其化合物性质有重要意义.
(1)研究硫及其化合物性质有重要意义.| [SO3]2 |
| [SO2]2[O2] |


科目:高中化学 来源: 题型:
| A、高氯精由4种元素组成 |
| B、高氯精中C、O、N、Cl的原子个数比为1:l:1:1 |
| C、高氯精中C、N两种元素的质量比为12:14 |
| D、高氯精中氯元素的质量分数为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量之比为1:1 |
| B、分子数之比为2:3 |
| C、原子总数之比为2:3 |
| D、质量之比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 普通漏斗 | 长颈漏斗 | 侧底烧瓶 | 蒸发皿 | 研钵 | 坩埚 | 烧杯 |
| 仪器 |  |
 |
 |
 |
 |
 |
 |
| 编号 | A | B | C | D | E | F | G |
查看答案和解析>>
科目:高中化学 来源: 题型:
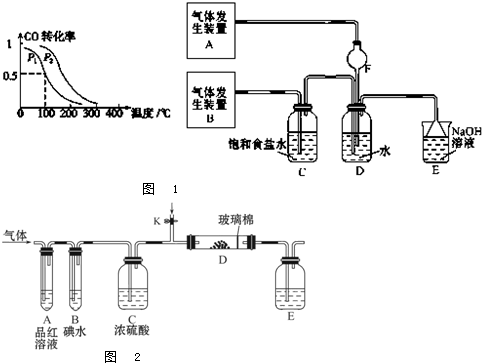
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H20、CH3COOH.Cu2 (OH)2CO3均含有氧元素,都是氧化物 |
| B、H2SO4、NaOH.NaCl均为强电解质,都属于离子化合物 |
| C、Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,都属于两性化合物 |
| D、溶液、胶体、浊液均为分散系,都属于混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com