
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
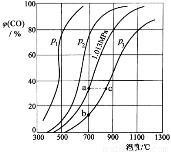
回答下列问题:
(1)p1、p2、p3的大小关系是______________,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为 。图中a、b、c三点对应的平衡常数大小关系是____________。
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为_________,该反应的平衡常数K= 。
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?_______,二者之间有何关系?____________________。
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g) CH4(g)+H2O(g) ∆H1=-206.2 kJ/mol
CH4(g)+H2O(g) ∆H1=-206.2 kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=-41.2 kJ/mol
CO2(g)+H2(g) ∆H2=-41.2 kJ/mol
① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是_________________。
② 已知298 K时相关化学键键能数据为:
化学键 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
则根据键能计算,∆H1= ,它与上述实测值差异较大的原因可能是 。
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:选择题
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
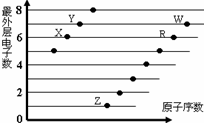
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性: X>R>W
D. 简单离子的半径:W>R>X
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:选择题
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如右图所示。下列说法不正确的是
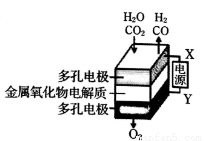
A.阴极的反应式是:H2O+2eˉ=H2+O2ˉ、CO2+2eˉ=CO+O2ˉ
B.X是电源的负极
C.总反应可表示为:H2O+CO2=H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
已知450℃时,反应H2(g)+I2(g)?2HI(g)的K=50,由此推测在450℃时,反应 2HI(g)?H2(g)+I2(g)的化学平衡常数为( )
A.50 B.0.02 C.100 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
把0.6molX、0.4molY混合后,在2L密闭容器中发生反应:3X(g)+Y(g)═nZ(g)+2W(g),5min末已生成0.2molW,并测得这段时间内v(Z)=0.01mol/(L•min).上述反应中Z的化学计量数n是( )
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三1月诊断性考试化学试卷(解析版) 题型:选择题
从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如下图,下列说法正确的是
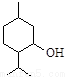
A.薄荷醇分子式为C10H20O,它是环己醇的同系物
B.薄荷醇的分子中至少有12个原子处于同一平面上
C.薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D.在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应
查看答案和解析>>
科目:高中化学 来源:2017届山东省潍坊市临朐县高三12月阶段测化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
⑴由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol- 1,
1,
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1,
①写出Cu2S与O2生成 Cu(s) 和SO2的热化学方程式: 。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
⑵氢化亚铜是一种红色固体,可由CuSO4溶液和H3PO2反应制备。该反应的化学方程式为 。该反应每转移3mol电子,生成CuH的物质的量为 。
⑶氯化铜溶液中含铜粒子的分布分数与c(Cl-) 的关系如图所示。①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜微粒浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜微粒间转化的离子方程式为 (任写一个)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省株洲市高三上教学质检一化学试卷(解析版) 题型:填空题
【选修3:物质的结构与性质】Ⅰ.氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7 、VF5 、CaF2 等。氟元素还可以和氧元素形成氟化物,如OF2 等。
请回答下列问题:
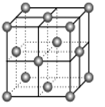
(1)V原子的核外电子排布式为 。如图表示一个不完整的CaF2 晶胞,则图中实心球表示 (填“F-或Ca2+ )。 设晶胞边长为a,则最近的F-和Ca2+之间的距离为 (用含a的代数式表示)。
(2)OF2 分子中氧原子的轨道杂化类型为 ,OF2被称为氟化物而不被称为氧化物的原因是 。
Ⅱ.纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物。回答下列问题:
(3)写出基态Cu+ 的核外电子排布式 。C、N、O三种元素的第一电离能由大到小的顺序是 。
(4)如图所示是铜的某种氧化物的晶胞示意图,该氧化物的化学式为 。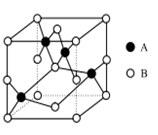
(5)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过键与中心离子Cu2+结合。NH3分子中的N原子杂化方式是 。与NH3分子互为等电子体的一种微粒是 (任写一种)
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期末化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是 ( )
A.氨气分子的电子式:
B.Mg2+结构示意图:
C.乙酸的结构简式:CH3COOH
D.乙醇的分子式C2H5OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com