
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(Ⅰ)德国人哈伯在1905年发明的合成氨反应原理为:N2(g)+3H2(g) ![]() 2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298 K下合成氨反应能自发进行(列出算式即可)___________________.其浓度熵(Qc) __________________化学平衡常数(Kc)(填“大于”“等于”或“小于”)时,反应向右进行.
(2)在实际工业合成氨生产中采取的措施是__________________ (填序号).
A.采用较低压强
B.采用800 K左右的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
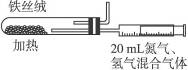
(3)如下图所示是实验室模拟工业法合成氨的简易装置,简述检验有氨气生成的方法
___________________________________________________________________________
___________________________________________________________________________.
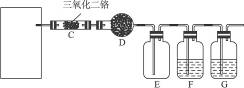
(Ⅱ)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取.某校化学兴趣小组的同学设计了如下图所示装置利用中学实验室常见试剂制取NH3,并以空气,NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):
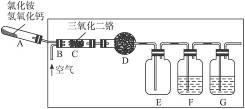
回答下列问题:
(1)实验时,A,C两装置均需加热,应先加热______________装置,原因是___________________;
(2)D装置中应填充的物质是______________,该物质的主要作用是______________;
(3)E装置的作用是______________,F,G装置中的物质分别是______________、______________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在如下图所示的方框中画出装置图并注明所用药品的名称).
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。
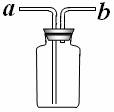
你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
(4)探究氨水与盐酸的反应过程。
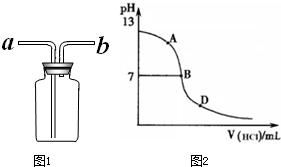
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图)。请回答:
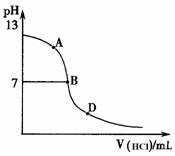
①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(08淄博市模拟)(18分)某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中

② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。
你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙该同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
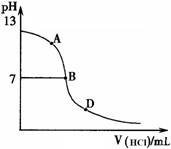 (4)探究氨水与盐酸的反应过程。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐
滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘
制其pH变化曲线(如图)。请回答:
①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com