
分析 (一)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,单质和混合物既不是电解质也不是非电解质,能够完全电离的电解质是强电解质,只能部分电离的电解质是弱电解质;
(二)(1)HCl为一元强酸,H2SO4为二元强酸,而CH3COOH为弱酸部分电离;
(2)同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸;
(3)反应速率与氢离子浓度有关,氢离子浓度相同,反应速率相同;由于醋酸在反应过程中电离程度增大,则醋酸与锌反应的平均速率最大;
(4)醋酸为弱酸,稀释过程中醋酸的电离程度增大,则稀释后醋酸中氢离子浓度最大,硫酸和盐酸溶液中氢离子浓度相等.
解答 解:(一)①酒精不能电离出自由移动的离子,属于非电解质;②氯化铵是盐,属于电解质,完全电离,是强电解质;③氢氧化钡属于碱,在熔融状态和溶于水均完全电离,属于强电解质;④氨水是氨气溶于水形成的混合物,既不是电解质也不是非电解质;⑤蔗糖不能电离出自由移动的离子,属于非电解质;⑥高氯酸属于强酸,是强电解质;⑦H2S是弱酸,属于弱电解质;⑧硫酸氢钾是盐,属于强电解质;⑨磷酸为中强酸,不能完全电离,属于弱电解质;⑩硫酸是强酸,属于强电解质,
(1)属于电解质的有②③⑥⑦⑧⑨⑩;
(2)属于强电解质的有②③⑥⑧⑩;
(3)属于弱电解质的有⑦⑨;
故答案为:(1)②③⑥⑦⑧⑨⑩;(2)②③⑥⑧⑩;(3)⑦⑨;
(二)(1)HCl为一元强酸,H2SO4为二元强酸,而CH3COOH为弱酸部分电离,物质的量浓度相同时,则c(CH3COOH)>c(H+),c(HCl)=c(H+),c(H2SO4)=0.5c(H+),所以氢离子浓度大小:b>a>c,
故答案为:b>a>c;
(2)同体积同物质的量浓度的三种酸溶液,中和NaOH溶液,盐酸和醋酸为一元酸,二者中和的氢氧化钠溶液的体积相同,而硫酸是二元酸,消耗氢氧化钠的体积为盐酸的2倍,则中和NaOH的能力大小为:b>a=c,
故答案为:b>a=c;
(3)反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,则反应时间c<a=b,
故答案为:a=b=c;a=b>c;
(4)强酸溶液稀释10倍,氢离子浓度变为原来的$\frac{1}{10}$,弱酸溶液稀释10倍,氢离子浓度大于原来的$\frac{1}{10}$,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b,
故答案为:c>a=b.
点评 本题考查电解质、强电解质、弱电解质的电离平衡、化学反应速率的影响因素等知识,题目难度中等,注意掌握影响化学反应速率、电离平衡的因素,明确弱电解质部分电离的特点,试题培养了学生的分析能力及灵活应用能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Na+、Cl-、SO42-、Fe3+ | |
| B. | 在强酸性的溶液中:Na+、SO42-、Cl-、NH4+ | |
| C. | 使紫色石蕊试液变红的溶液中:Na+、Mg2+、CO32-、Cl- | |
| D. | 含SO42-的水溶液中:K+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应 | B. | 放热反应 | C. | 化合反应 | D. | 可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
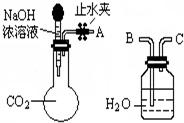 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
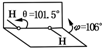 我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2是极性分子 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com