
| A、Cu与Cu2O 的物质的量之比为1:2 |
| B、产生的NO在标准状况下的体积为3.36L |
| C、硝酸的物质的量浓度为2.4mol/L |
| D、Cu、Cu2O与硝酸反应后剩余HNO3为0.4mol |
| 39.2g |
| 98g/mol |
| n |
| V |
| 39.2g |
| 98g/mol |
| 0.2mol×2+0.1mol×2 |
| 5-2 |
| 1.2mol |
| 0.5L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、x=3 y=1 |
| B、x=4 y=1 |
| C、x=5 y=1 |
| D、x=8 y=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
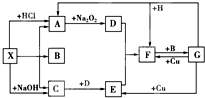 如下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是白色固体,H是黑色固体单质,B是液体,A、C、D、E、F均为气体,且C气体遇到石蕊变蓝,1mol X加热分解得到A、B、C各1mol.
如下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是白色固体,H是黑色固体单质,B是液体,A、C、D、E、F均为气体,且C气体遇到石蕊变蓝,1mol X加热分解得到A、B、C各1mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol?L-1 |
| B、上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
| C、与0.05 mol?L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+) |
| D、溶液中c(H+)+c(A-)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石溶于醋酸溶液中:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O |
| B、钠与硫酸铜溶液反应:Cu2++2Na═2Na++Cu |
| C、过量铁屑溶于稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方程式 | 反应类型 | ||
| ①乙烷生成一氯代物 | |||
| ②丙烯通入溴水中 | |||
| ③丙烯加聚 | |||
| ④实验室制备乙烯 | |||
| ⑤苯的硝化 | |||
| ⑥苯的溴代 | |||
⑦CH3-CH=CH2+Cl2
|
|||
⑧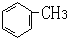
|
|||
⑨CH2=CHCH3
|
|||
| ⑩1-溴丙烷与氢氧化钠水溶液 | |||
| ?2-溴丙烷与氢氧化钠的乙醇溶液共热 | |||
| ?乙醇与金属钠反应 | |||
| ?乙醇与乙酸 | |||
| ?丙醇的催化氧化 | |||
| ?2-丙醇的催化氧化 | |||
| ?苯酚与氢氧化钠溶液 | |||
| ?苯酚滴加到溴水中 | |||
| ?乙醛与新制氢氧化铜悬浊液加热 | |||
| ?乙醛与银氨溶液水浴加热 | |||
| ?乙醛与氢氰酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com