
分析 根据题意,在400℃左右、有催化剂存在的条件下,用氨气把NO还原为氮气和水,反应的化学方程式即可;
天然气的主要成分是CH4,CH4的还原性强于NH3,甲烷和一氧化氮反应生成二氧化碳、氮气、水,据此分析解答.
解答 解:在400℃左右、有催化剂存在的条件下,用氨气把NO还原为氮气和水,反应的化学方程式为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O.
天然气的主要成分是CH4,CH4的还原性强于NH3,则CH4可与NO发生如下反应:4NO+CH4$\frac{\underline{\;催化剂\;}}{\;}$CO2+2N2+2H2O,相同质量的CH4和NH3还原NO,CH4还原的NO多,且天然气资源丰富,可使生产成本降低,
故答案为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O;4NO+CH4$\frac{\underline{\;催化剂\;}}{\;}$CO2+2N2+2H2O.
点评 本题综合考查含氮化合物知识,侧重于学生的分析能力和元素化合物知识的理解和运用的考查,为高考高频考点,注意氧化还原知识在该题中的分析应用,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
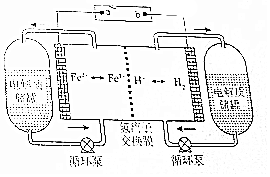 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a可能是40,m>n | B. | a可能是40,m=n | C. | a可能是30,m>n | D. | a可能是30,m<n |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com