
【题目】如图为镁-间二硝基苯电池的工作原理示意图。已知:电池放电时,铁转化为氢氧化镁,间二硝基苯则转化为间苯二胺。下列说法不正确的是
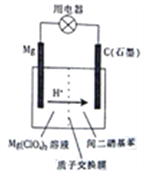
A. 电池放电时,电子由镁电极流出经过用电器流向石墨电极
B. 电池放电时,镁电极附近的电解质溶液的pH降低
C. 电池放电时,理论上每生成1mol间苯二胺就有12molH+通过质子交换膜
D. 电池放电时,石墨电板上发生的反应为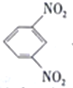 +12H+-12e-=
+12H+-12e-=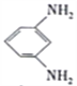 +4H2O
+4H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中每个数字编号代表一种短周期元素。
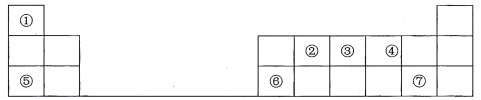
请按要求回答下列问题:
(1)元素①的元素符号是___________;元素②的元素名称是_____________。
(2)元素⑤处于周期表中第____________周期第________________族。
(3)①~⑦七种元素中原子半径最大的是_______________ (填元素符号);②③④三种元素的最简单氢化物中最稳定的是___________________(填化学式)。
(4)元素③和元素⑦的氢化物均极易溶于水,且二者能反应产生大量白烟,写出该反应的化学方程式_________________________________________________________________。
(5)元素⑥的最高价氧化物对应的水化物是一种__________性氢氧化物,该物质与元素⑤的最高价氧化物对应水化物反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。


据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式 .
(2)根据元素周期律,原子半径GaAs,第一电离能GaAs.(填“大于”或“小于”)
(3)AsCl3分子的立体构型为 , 其中As的杂化轨道类型为 .
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 .
(5)GaAs的熔点为1238℃,密度为ρ gcm﹣3 , 其晶胞结构如图所示.该晶体的类型为 , Ga与As以键键合.Ga和As的摩尔质量分别为MGa gmol﹣1和MAs gmol﹣1 , 原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为 . 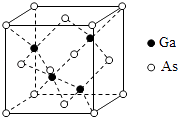
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣=2Fe2++I2+3H2O
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO ![]() +Ca2++OH﹣═CaCO3↓+H2O
+Ca2++OH﹣═CaCO3↓+H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO ![]() +6H++5H2O2=2Mn2++5O2↑+8H2O
+6H++5H2O2=2Mn2++5O2↑+8H2O
D.AlCl3溶液与过量的浓氨水:Al3++4NH3?H2O=AlO2﹣+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂贮存方法错误的是( )
A.钠应保存在煤油中B.氢氟酸保存在玻璃瓶中
C.新制氯水保存在棕色试剂瓶中D.烧碱溶液可用带橡胶塞的玻璃瓶暂时保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示: 
下列说法不正确的是( )
A.x为NaOH溶液,y为盐酸
B.a→b发生的反应为:AlO2﹣+H++H2O═Al(OH)3↓
C.b→c→Al的反应条件分别为:加热、电解
D.a、b、c既能与酸又能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阐明生命现象的规律,必须建立在阐明生物大分子结构的基础上,下列关于组成细胞的分子的说法,正确的是( )
A. 细胞中的大分子化合物均以碳链为骨架,因此碳是细胞内含量最多的元素
B. 细胞中的脂质分子的氧的含量远远多于糖类,而氢的含量更少
C. 在小鼠细胞内检测到某化合物的分子式为C12H22O11,它可能是蔗糖
D. 生物体内的无机盐离子,必须保持一定的量,这对于维持细胞的酸碱平衡非常重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)E元素形成的氧化物对应的水化物的化学式为_______________________________。
(2)元素C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。
(3)用电子式表示化合物D2C的形成过程:_________________。C、D还可形成化合物D2C2,D2C2中含有的化学键类型是_______________________________________________。
(4)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com