
分析 (1)根据反应 2CrO42-+2H+═?Cr2O72-+H2O及平衡常数K═9×1013,计算出c(H+),从而计算溶液的pH;
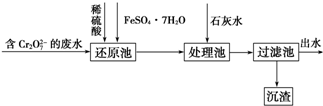
(2)含Cr2O72-的废水,在酸性条件下加入硫酸亚铁,发生氧化还原反应生成Cr3+、Fe3+,然后加入过量石灰水,可得到Cr(OH)3、Fe(OH)3沉淀,以此解答该题;
(3)在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,同时生成Cr3+,根据元素守恒和元素守恒书写离子方程式,根据反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O 可计算出多余的K2Cr2O7,进而计算出与甲醇反应的K2Cr2O7,再计算出样品中的甲醇,计算甲醇的质量分数.
解答 解:(1)酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为26g,CrO42-有90%转化为Cr2O72-,
根据守恒列关系式:2Cr~2CrO42-~Cr2O72-
2 1
$\frac{26g×\frac{9}{10}}{52g/mol}$ n(Cr2O72-)
得n(Cr2O72-)=0.225mol,
n(CrO42-)剩余=0.05mol;
则酸化后所得溶液中c(Cr2O72-)=0.225mol•L-1; c(CrO42-)剩余=0.05mol•L-1
设H+的物质的量浓度为amol/L,
2CrO42-+2H+?Cr2O72-+H2O
平衡(mol/L) 0.05 a 0.225
平衡常数K=$\frac{0.225}{0.05{\;}^{2}×a{\;}^{2}}$═9×1013,
则a=1.0×10-6mol/L,所以pH=6,
故答案为:6;
(2)含Cr2O72-的废水,在酸性条件下加入硫酸亚铁,发生氧化还原反应生成Cr3+、Fe3+,然后加入过量石灰水,可得到Cr(OH)3、Fe(OH)3沉淀,还原池中发生反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,溶液的pH=8,c(OH-)=10-6 mol/L,根据Ksp(Cr(OH)3)=c(Cr3+)•c3(OH-),可知c(Cr3+)=$\frac{Ksp(Cr(OH){\;}_{3})}{{c}^{3}(OH{\;}^{-})}$=6.3×10-13mol/L,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;6.3×10-13mol/L;
(3)在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,同时生成Cr3+,反应的离子方程式为CH3OH+Cr2O72-+8H+═CO2↑+2Cr3++6H2O,
根据反应CH3OH+Cr2O72-+8H+═CO2↑+2Cr3++6H2O …①;Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O …②
由反应②可知,反应①剩余的n(Cr2O72-)=$\frac{1}{6}$n(Fe2+)=0.0016 mol,所以反应①消耗的n(Cr2O72-)=0.0050 mol-0.0016 mol=0.0034 mol
则n(CH3OH)=0.0034 mol,则w(CH3OH)=$\frac{0.0034mol×32g/mol}{0.12g}$×100%=90.7%,
故答案为:CH3OH+Cr2O72-+8H+═CO2↑+2Cr3++6H2O;90.7%.
点评 本题考查物质的分离、提纯的综合应用,为高考常见题型,侧重于学生的分析能力和实验能力的考查,本题注重氧化还原反应的计算,难度不大,离子的检验是高考的热点,注意离子方程式的书写.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氮气的化学性质比氧气稳定 | |
| B. | 常温、常压下,溴呈液态,碘呈固态 | |
| C. | 稀有气体一般很难发生化学反应 | |
| D. | 相同状态下,氯气的密度比空气的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-5△H2-12△H3 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | 12△H3+5△H2-2△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用pH试纸测定浓硫酸的pH | |
| B. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| C. | 用甲图装置验证FeCl3对H2O2分解反应有催化作用 | |
| D. | 用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径小于W的简单离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Z的气态简单氢化物的稳定性比X的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解饱和食盐水,当线路中通过NA个电子时,阳极生成11.2L气体(标准状况下) | |
| B. | 把5.6g铁片投入到足量的冷的浓硝酸中,转移电子数为0.3NA | |
| C. | 12g石墨晶体中含有碳碳单键数为1.5NA | |
| D. | 15g-CH3中含有的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com