
【题目】下列关于铜及其化合物的说法不正确的是( )
A.人类对金、银、铜、铁、铝的认识与其金属活动性顺序无关
B.将灼热的铜丝伸入盛满氯气的集气瓶中,有棕黄色的烟生成
C.蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是化学变化
D.工业上可用空气、Cu、稀硫酸来制备CuSO4
科目:高中化学 来源: 题型:
【题目】下列能用勒沙特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列六组物质:属于同系物的是_________,属于同分异构体是_________,属于同种物质的是___________。(填序号)

(2)下列实验设计或操作合理的是_______________。
a.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
b.只用水就能鉴别苯、硝基苯、乙醇;
c.实验室通过浓硫酸与乙醇反应制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度;
d.将电石与饱和食盐水反应后,直接通入酸性KMnO4溶液检验是否得到乙炔。
(3)按要求书写:
①乙炔的电子式______;②  的系统命名为___________________。
的系统命名为___________________。
③相对分子质量为72且沸点最低的烷烃的结构简式___________________;
④某单烯烃的相对分子质量为84,若该分子内所有碳原子均在同一平面内,则其结构简式为_______________。
⑤C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是( )
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A. ΔH4﹦2ΔH32ΔH2ΔH1
B. O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C. 1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)
D. 联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:

(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的仪器是________(填序号);

(2)步骤Ⅰ中加入过量铁粉的目的是________;步骤Ⅱ中________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤Ⅲ的实验装置如图所示,加热装置应与装置________(填“甲”“乙”或“丙”)连接,理由是_____________

(4)利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉,过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案________(填“甲”“乙”或“丙”,下同)不好;从产品纯度考虑,方案________不好。
(5)写出步骤Ⅰ中涉及反应的离子方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步实现直接完成的是( )
A.Al(OH)3→Al2O3B.Al2O3→Al(OH)3
C.Al→NaAlO2D.AlCl3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
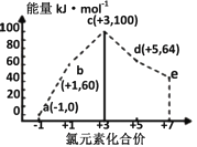
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图,下列说法正确的是

A. 若B处液面上升,A溶液可能是酸性溶液
B. 若A为NaCl溶液,B、C液面始终保持不变
C. 可能产生Fe2O3·nH2O
D. 腐蚀的总反应式一定是:2Fe + O2 + 2H2O === 2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸甲酯又叫冬青油,是一种重要的有机合成原料。某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时;
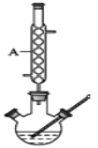
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是___________,制备水杨酸甲酯时,最合适的加热方法是__________。
(2)实验中加入甲苯对合成水杨酸甲酯的作用是_____________________。
(3)反应结束后,分离甲醇的操作是_____________。
(4)洗涤操作中,第一次水洗的主要目的是__________,第二次水洗的主要目的是________。
(5)检验产品中是否含有水杨酸的化学方法是________________________。
(6)本实验的产率为___________(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com