
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
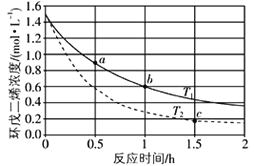
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率小于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是___________;其与水反应的化学方程式为______________________。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为____________。氧原子的核外电子排布式为_________________。
(3)与同主族元素Mg相比,Ca的金属性更______(填“强”或者“弱”)。能证明这一结论的实验事实是________________________。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g)。完成下列填空:
CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是____________。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | C | H2 | CO | |||
1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为____________。
②下列图像正确的是________。(选填编号)
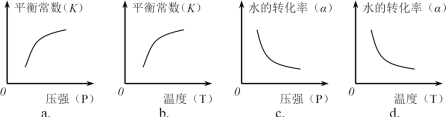
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O电子式为____________。
(2)下列能判断Cl和O两种元素非金属性强弱的是______(选填编号)。
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是________,氧化产物________。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
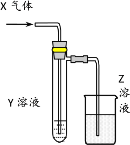
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
A.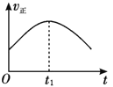 B.
B.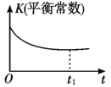
C. D.
D.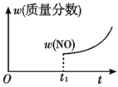
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
(ⅰ)2H2(g)+CO(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
(ⅱ)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
(1)则4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)的ΔH=___(用含ΔH1、ΔH2的式子表示)
CH3OCH3(g)+H2O(g)的ΔH=___(用含ΔH1、ΔH2的式子表示)
(2)在恒容密闭容器中发生反应(ⅰ),
(Ⅰ)如图能正确反映平衡体系中甲醇体积分数随温度变化情况的曲线是__(填“a”或“b”);
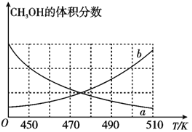
(Ⅱ)下列说法能表明反应(ⅰ)已达平衡状态的是__;
a.容器中气体的压强不再变化 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不再变化 d.v正(H2)=2v正(CH3OH)
(Ⅲ)300℃下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,x=__。
的变化关系如图所示,测得D点氢气的转化率为40%,x=__。
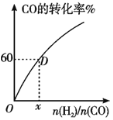
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化汞(HgCl2)可用于木材和解剖标本的保存、皮革鞣制和钢铁镂蚀,是分析化学的重要试剂,还可做消毒剂和防腐剂。HgCl2在水中稍有水解:HgCl2+H2O![]() Hg(OH)Cl+HCl
Hg(OH)Cl+HCl
(1)为了抑制上述反应中HgCl2的水解,可以采取的措施是_________。(选填编号)
a.加水稀释 b. 增加HCl的浓度 c.及时移走产物 d.降温
(2)HgCl2与稀氨水反应则生成难溶解的氨基氯化汞,化学方程式为HgCl2+2NH3→Hg(NH2)Cl↓+NH4Cl,上述反应的短周期元素中,非金属性最强元素原子的最外层轨道排布式为__________,该原子核外电子云有_________种不同的伸展方向。
(3)已知PCl3与NH3分子结构相似,PCl3的电子式是_______________;PCl3与NH3的沸点比较,______高,其原因是_______________________。
(4)氮的一种氢化物HN3可用于有机合成,其酸性与醋酸相似,若HN3与氨水混合,此反应的化学方程式是_______________________。
(5)若将0.4mol/LNH4Cl与0.2mol/LNaOH溶液等体积混合后,PH=10,下列关系正确的是(______)
A.c(NH4+)>c(OH-)>c(Na+)>c(NH3H2O) >c(H+)
B.c(NH4+)>c(Na+)>c(OH-)>c(NH3H2O) >c(H+)
C.c(NH4+)>c(Na+)>c(OH-)>c(H+)>c(NH3H2O)
D.c(NH4+)>c(Na+)>c(NH3H2O) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A.d为石墨,电流从d流入导线进入铁片
B.d为铜片,铜片上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为镁片,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Na2S2,其溶液显黄色并有强碱性。
(1)写出该反应的化学方程式:___________________________________。并写出Na2S2的电子式___________该物质中所具有的化学键的类型_______________;该反应中的Na2S表现了_____________性,当生成1mol Na2S2时,转移电子数目为___________。
(2)在碱性溶液中,多硫化钠Na2Sx(x≥2),可被NaClO氧化为硫酸钠,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则X的值为________。
A.5 B.4 C.3 D.2
(3)常温下Na2S溶液显______(填酸性、中性或碱性),理由是(用离子方程式表示)__________________________。
(4)常温pH=10的0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com