
| A. | 植物油和自来水(蒸馏) | B. | 水溶液中的食盐和碘(分液) | ||
| C. | CaCO3和CaCl2(溶解、过滤、蒸发) | D. | 泥水中的不溶性泥沙(萃取) |
科目:高中化学 来源: 题型:解答题
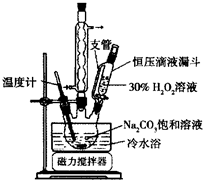 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
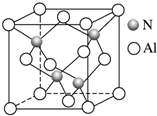 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 塑料 | B. | 玻璃 | C. | 淀粉 | D. | 合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 稀硫酸和Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | CuSO4和NaOH溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| D. | 单质铜和AgNO3溶液反应:Cu+2Ag+═Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
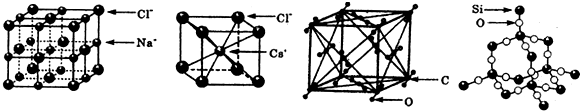
| A. | 干冰的晶胞中含有6个CO2分子 | |
| B. | 干冰是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| C. | 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键 | |
| D. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是一种重要的化工产品.
氨是一种重要的化工产品.| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com