
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
分析 在饱和硫酸铜溶液中加入无水硫酸铜粉末,发生:CuSO4+xH2O=CuSO4•xH2O,导致溶液中水的量减少,会导致平衡:Cu2++SO42-+xH2O?CuSO4•xH2O向正方向移动,则析出晶体后溶液仍为饱和溶液,溶液浓度不变,但是溶液中铜离子数目减少,以此解答该题.
解答 解:A.由于溶液仍为饱和溶液,则溶液中Cu2+浓度不变,故A错误;
B.由于Cu2++SO42-+xH2O?CuSO4•xH2O向正方向移动,溶液中Cu2+数目减少,故B正确;
C.溶液浓度不变,则pH不变,故C错误;
D.溶液中铜离子浓度不变,则溶液颜色不变,故D错误.
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意加入硫酸铜固体后溶液中溶剂的质量减少,析出更多的晶体,析出后仍为饱和溶液,理解该点为解答该题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe (OH )3 溶于稀 H 2 SO4 中:H++OH-→H2O | |
| B. | 氨水滴入 AlCl 3 溶液中:Al3++3OH-→Al(OH)3↓ | |
| C. | FeO 溶于稀 HCl 中:O2-+2H+→H2O | |
| D. | 铝溶解在 NaOH 溶液中:2Al+2OH-+2H2O→2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2CH2OH | B. | CH2CH(OH)CH2OH | C. | CH2CH2OH | D. | HOCH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z,平衡常数为1600 | |
| C. | 其他条件不变时,增大压强可使平衡常数增大 | |
| D. | 改变温度可以改变该反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| B. | 两清液混合,AgCl和AgI都沉淀 | |
| C. | 若取0.1435 g AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01 mol/L | |
| D. | 向AgI清液加入AgNO3,c(Ag+)增大,Ksp(AgI)也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | 滤液b中不含有Ag+ | |
| C. | ③中颜色变化说明AgCl转化为AgI | |
| D. | 实验可以证明AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 | |
| D. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
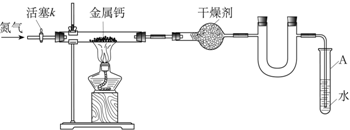
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 120.8 | 122.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com